微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
(1)L的电子式为______
(2)指出F在工业上的一种用途______
(3)反应②的离子方程式为______
(4)若利用反应④设计成原电池,其负极反应式为______
(5)除反应⑤外,还有多种化学反应可由H生成K.下列物质能与H反应生成K的是______(填选项字母)
a.CO2?b.NaHCO3?c.NaHSO4?d.NaClO?e.NH4NO3?f.NH3?H2O
(6)反应①中,当有4.0g?B参加反应时,放出的热量为20.1kJ,则该反应的热化学方程式为______.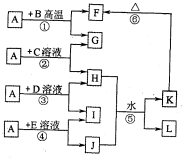
参考答案:A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,故G为Cu,A为Al,L是由两种元素组成的盐,它是家庭厨房必备物品,L为NaCl;
B为黑色粉末,由反应①可知,B为CuO,F为A12O3,由反应⑥可知,K为Al(OH)3;
由反应②可知,C为铜盐,H为铝盐,I为单质,由反应④可知,J中含有Al元素,故反应⑤为铝盐与偏铝酸盐反应生成Al(OH)3与NaCl,为AlCl3+NaAlO2→Al(OH)3+NaCl,故H为AlCl3,J为NaAlO2,C为CuCl2;
由反应③可知,D为盐酸,I为氢气;由反应④可知,E为NaOH,则
(1)L为NaCl,由钠离子与氯离子构成,电子式为:

;
故答案为:

;
(2)F为A12O3,可以用作冶炼铝的原料或用作耐火材料;
故答案为:用作冶炼铝的原料或用作耐火材料;
(3)反应②是Al与氯化铜反应生成氯化铝与铜,反应离子方程式为:2Al+3Cu2+=2Al3++3Cu;
故答案为:2Al+3Cu2+=2Al3++3Cu;
?(4)反应④为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,将该反应设计成原电池,负极发生氧化反应,Al在负极放电,电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;
故答案为:Al-3e-+4OH-=AlO2-+2H2O;
(5)能与AlCl3反应生成Al(OH)3的物质有:碱或水解呈碱性的物质,AlCl3溶液与NaHCO3溶液、NaClO溶液发生双水解反应生成Al(OH)3,AlCl3溶液与NH3?H2O反应生成Al(OH)3与氯化铵;
故选cdf;
(6)反应①为2Al+3CuO=Al2O3(s)+3Cu,4.0gCuO的物质的量为4g80g/mol=0.05mol,3molCuO反应放出的热量为20.1kJ×3mol0.05mol=1206kJ,该反应的热化学方程式为:2Al(s)+3CuO(s)=Al2O3(s)+3Cu(s);△H=-1206?kJ/mol;
故答案为:2Al(s)+3CuO(s)=Al2O3(s)+3Cu(s);△H=-1206?kJ/mol.
本题解析:
本题难度:一般
2、填空题 各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
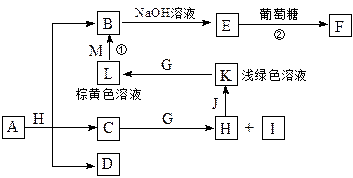
请回答下列问题:
(1)写出A的化学式______________,C的电子式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
_______________________________________________。
(4)研究表明:气体D在一定条件下可被 还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____、______、_______。
还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称____、______、_______。
参考答案:(1)CuCO3或Cu2(OH)2CO3或Cu(OH)2·CuCO3;
(2)C>O
(3)3Cu2O+14HNO3 6Cu(NO3)2+2NO↑+7H2O
6Cu(NO3)2+2NO↑+7H2O
(4)金刚石、石墨、富勒烯。(或无定型炭、炭纳米管等)
本题解析:略
本题难度:一般
3、填空题 下表是元素周期表的一部分,A、B、C、D、E、X是下表中给出元素组成的常见单质或化合物。

已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

(1)若E为单质气体,D为白色沉淀,A的化学式可能是?, C与X反应的离子方程式为?。
(2)若E为氧化物,则A与水反应的化学方程式为?。
①当X是碱性盐溶液,C分子中有22个电子时,则C的结构式为?,表示X呈碱性的离子方程式为 ?。
②当X为金属单质时,X与B的稀溶液反应生成C的离子方程式为?。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,写出该可逆反应的化学方程式?。t℃时,在密闭恒容的某容器中投入等物质的量的D和水蒸气,一段时间后达到平衡,该温度下反应的平衡常数K=1,D的转化率为?。
参考答案:(1)Na(NaH? Na2O2) Al3++3AlO2-+6H2O=4Al(OH)3↓
(2)3NO2+H2O=2HNO3+NO
①O=C=O? CO32?+H2O HCO3?+OH?
HCO3?+OH?
②Fe+4H++NO3?=Fe3++NO↑+2H2O
(3)CO+H2O  CO2+H2? 50%
CO2+H2? 50%
本题解析:根据元素在周期表中的位置可判断元素的种类,①为H元素,②为Na元素,③为Al元素,④为C元素,⑤为N元素,⑥为O元素,⑦为Cl元素。
(1)根据表中的元素可知,只有⑤形成的物质与水反应生成氢气,则A可能为Na、Na2O2或NaH;白色沉淀为Al(OH)3, C与X反应的离子反应为3AlO2-+Al3++6H2O═4Al(OH)3↓。
(2)根据表中的元素可知,只有③形成的物质与水反应生成NO气体符合,则A为NO2,A与水反应生成硝酸和一氧化氮,其反应为3NO2+H2O═2HNO3+NO。
①硝酸与碳酸盐反应生成二氧化碳,分子中有6+8×2=22个电子,C为CO2,结构式为:O=C=O;CO32?水解使X溶液显碱性,离子方程式为:? CO32?+H2O HCO3?+OH?
HCO3?+OH?
②当X为金属时,应为变价金属Fe,X与B的稀溶液反应生成C的离子方程式为:Fe+4H++NO3?=Fe3++NO↑+2H2O。
(3)若B为单质气体,D可与水蒸气在一定条件下发生可逆反应,生成C和一种可燃性气体单质,则A为Na2O2,B为O2,X为C,CO与水蒸气反应生成二氧化碳和氢气,该反应为:CO+H2O  CO2+H2;设开始时CO和H2O的物质的量为1mol,转化的CO为x,则
CO2+H2;设开始时CO和H2O的物质的量为1mol,转化的CO为x,则
CO+H2O  CO2+H2
CO2+H2
起始量(mol)? 1?1? 0? 0?
变化量(mol)?x?x?x? x
平衡量(mol)? 1-x 1-x? x? x
则x2/(1-x)2=1,可得x=0.5,CO的转化率为0.5mol÷1mol×100%=50%。
本题难度:困难
4、推断题 如图A~J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体。
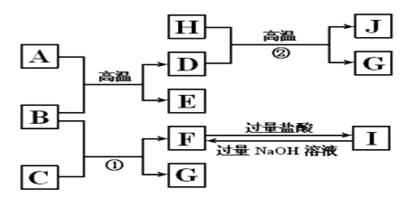
根据图示回答问题:
(1)写出下列物质的化学式:B________,E________,I________;
(2)写出反应A+B→E+D的一种用途__________________;
(3)反应①的离子方程式是_________________________________________;
反应②的化学方程式是__________________________________________;
(4)J与盐酸反应的化学方程式是__________________?_________________;
反应后的溶液与D反应的离子方程式是___________________________________。
参考答案:共16分
(1) Al Al2O3 AlCl3(每空2分共6分)
(2) (1)焊接钢轨(或其他合理答案)?(2分)
(3)2Al+2OH-+2H2O===2AlO2—+3H2↑?(2分)
3Fe+4H2O(g)  ?Fe3O4+4H2?(2分)
?Fe3O4+4H2?(2分)
(4)Fe3O4+8HCl===FeCl2+2FeCl3+4H2O?(2分)
2Fe3++Fe===3Fe2+?(2分)
本题解析: B是地壳中含量最高的金属元素,B是Al,J是磁性材料Fe3O4,D是单质,D是Fe,H为无色液体,H是H2O, G是单质,G是H2,A是Fe2O3,E是Al2O3,C是NaOH,F是NaAlO2,I是AlCl3。
(1) B是Al,E是Al2O3,I是AlCl3。
(2)铝置换铁,故用途是焊接钢轨。
(3) 反应①是Al和NaOH反应生成H2,离子方程式是2Al+2OH-+2H2O===2AlO2—+3H2↑。反应②Fe和水蒸气的反应,方程式是3Fe+4H2O(g)  ?Fe3O4+4H2。
?Fe3O4+4H2。
(4) J是 Fe3O4与盐酸的反应方程式是Fe3O4+8HCl===FeCl2+2FeCl3+4H2O。
Fe能还原Fe3+,故离子方程式是2Fe3++Fe===3Fe2+。
点评:此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论。
本题难度:一般
5、推断题 如图所示,A、B、C、D、E、F、G、H、I、J 10种物质是中学化学中常见的物质,在一定条件下相互转化,A 是原子半径最小的元素形成的气体单质,C是能使红色石蕊试纸变蓝的气体,J溶液呈蓝色,反应①②③为重要的工业反应,G的相对分子质量是F的两倍。B、C、E、 F、G、H、J中含有一种相同的元素。
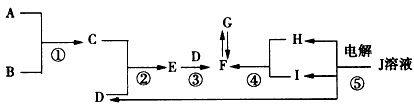
(1)写出B分子的结构式:_____________________。
(2)写出电解J溶液的化学方程式:_______________。
(3)C与H反应生成的化合物中所含化学键的类型是_______________。
(4)气体F、G混合呈____色,将混合气体置于注射器中,将活塞迅速向外拉到一定位置,可观察到_________________________。
参考答案:(1) N N
N
(2)2Cu(NO3)2+2H2O 2Cu+O2↑+4HNO3
2Cu+O2↑+4HNO3
(3)共价键、离子键
(4)红棕;气体颜色先变浅再变深
本题解析:
本题难度:一般