微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 P轨道电子云形状正确的是
A.球形对称
B.圆形对称
C.极大值在x、y、z轴上的纺锤形
D.互相垂直的花瓣形
参考答案:C
本题解析:考查能级轨道和电子云的特点。P轨道电子云形呈纺锤形,所以正确的答案是C。【题型】选择题
本题难度:简单
2、填空题 A、B、C、D四种短周期元素的原子半径依次减小,在周期表中B与A、C相邻,C的最外层电子数 是其电子总数的3/4,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
是其电子总数的3/4,D能分别与A、B、C形成电子总数相等的化合物X、Y、Z。试回答:
(1)在X、Y、Z三种化合物中稳定性由强到弱的顺序是 。
(2)若由A、B、C、D四种元素组成一种离子化合物,1mol该化合物中 含有10mol原子,则该化合物受热分解的化学方程式为 ? 。
含有10mol原子,则该化合物受热分解的化学方程式为 ? 。
(3)Y跟HCl反应生成固体W。该固体跟有毒的工业盐NaNO2的水溶液混合加热,NaNO2中的化学键被完全破坏,当有1mol NaNO2发生反应时,共有3mol电子转移,该反应的化学方程式为 ?。
(4)常温下,pH=5的W的水溶液和HCl的稀 溶液中由水电离出来的H+离子浓度之比为? 。
溶液中由水电离出来的H+离子浓度之比为? 。
参考答案:(1) H2O>NH3>CH4 。
(2) NH4HCO3NH3↑+CO2↑+H2O 。
(3) NH4Cl+NaNO2===NaCl+2H2O+N2↑ 。
(4) 104∶1 。
本题解析:略
本题难度:一般
3、选择题 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
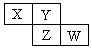
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
参考答案:B
本题解析:
分析:短周期元素,由图可知X、Y在第二周期,Y原子的最外层电子是内层电子数的3倍,则Y为氧元素,依次推出X为氮元素,Z为硫元素,W为氯元素,然后利用非金属性的强弱来分析解答.
解:短周期元素,由图可知X、Y在第二周期 ,Y原子的最外层电子是内层电子数的3倍,即K层电子为2,L层为6,其质子数为8,则Y为氧元素,由元素在周期表中的位置可知X为氮元素,Z为硫元素,W为氯元素,
A、同周期从左到右元素的非金属性增强,则非金属性Y>X,所以Y的气态氢化物比X的稳定,故A错误;
B、同周期从左到右元素的非金属性增强,则非金属性W>Z,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C、同主族元素从上到下非金属性减弱,则非金属性Y>Z,故C错误;
D、X与Y形成的化合物NO不溶于水,故D错误;
故选B.
本题难度:一般
4、选择题 A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是? (? )
A四种元素A、B、C、D分别为O、Ca、Na、Ar
B.元素A、B、C两两组成的化合物可为CaO、Ca02、Na2 0、 Na2 02等
C元素A、C简单离子的半径大小关系为A<C
D-元素A、C电负性大小关系为A>C
参考答案:C
本题解析:A元素是地壳中含量最多的元素,则A是O;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和,所以B是Ca;金属性越强,第一电离能越小,所以C是Na,D是Ar。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,氧原子的质子数小于钠原子的质子数,所以氧离子半径大于钠离子半径,选项C不正确,其余都是正确的,答案选C。
本题难度:一般
5、填空题 Q、W、X、Y、Z五种短周期元素,原子序数依次增大。Q在元素周期表中原子半径最小,W元素最高正价与最低负价代数和为0;Y与Q同主族;X、Z分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)X、Z简单离子半径较大是?(用离子符号表示)。
(2)由这五种元素中的若干种组成的化合物甲、乙、丙、丁在水溶液中有如下转化关系: ,其中丙是溶于水显酸性的气体,丁是强碱。
,其中丙是溶于水显酸性的气体,丁是强碱。
①若乙常作为焙制糕点的发酵粉,则乙含有的化学键类型有?;乙溶液中阳离子浓度之和?阴离子浓度之和(填“>”、“=”或“<”)。
②若乙是难溶物,甲溶液与过量的丙生成乙的离子方程式为:?。
参考答案:(1)O2-(2分)
(2)①离子键、共价键(2分)?>(2分)
②[Al(OH)4]-+CO2=Al(OH)3↓+ HCO3-(3分)
本题解析:Q在元素周期表中原子半径最小,Q为H元素,X、Z分别是地壳中含量最高的非金属元素和金属元素,X为O元素、Z为Al元素,W元素最高正价与最低负价代数和为0,W为ⅣA族元素,根据原子序数依次增大,所以W为C元素,Y与Q同主族,则Y为Na元素。
(1)电子排布相同的离子,原子序数越大,离子半径越小,所以O2?半径大于Al3+半径。
(2)丙是溶于水显酸性的气体,丁是强碱,则丙为CO2,、丁为NaOH。
①若乙常作为焙制糕点的发酵粉,则乙为NaHCO3,含有的化学键有:离子键、共价键;阳离子为H+、Na+,阴离子为HCO3?、OH?、CO32?,根据电荷守恒可得:c(H+)+c(Na+)=c(HCO3?)+c(OH?)+2c(CO32?),所以阳离子浓度之和>阴离子浓度之和。
②若乙是难溶物,则乙为Al(OH)3,甲溶液与过量的丙生成乙的反应为Na[Al(OH)4]与CO2反应生成Al(OH)3沉淀和NaHCO3,离子方程式为:[Al(OH)4]-+CO2=Al(OH)3↓+ HCO3-。
本题难度:一般