微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
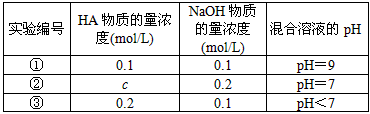
请回答
(1)从①组情况分析,HA是强酸还是弱酸?____________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____________0.2 mol/L(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是____________。
(3)从③组实验结果分析,说明HA的电离程度____________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是____________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
参考答案:(1)弱酸
(2)大于;c(A-)==c(Na+)
(3)大于;c(A-)>c(Na+)>c(H+)>c(OH-)
本题解析:
本题难度:一般
2、选择题 关于0.1 (CH3COO)2Ba溶液的说法正确的是
(CH3COO)2Ba溶液的说法正确的是
[? ]
A.溶液呈碱性,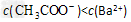
B.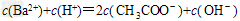
C.
D.加入少量Ba(OH)2固体,溶液中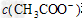 和c(Ba2+)均增大
和c(Ba2+)均增大
参考答案:D
本题解析:
本题难度:一般
3、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:

(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸____。
(2)不考虑其他组的实验结果,单从乙组情况分析,c是否一定等于0.2____(填“是”或“否”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是________。
(3)由丙组实验结果分析,HA是____酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=____mol·L-1。 写出该混合溶液中下列算式的精确结果(不能做近似计算)。 c(Na+)-c(A-)=____mol·L-1? c(OH-)-c(HA)=____mol·L-1
参考答案:(1)若a=7,则HA是强酸,若a>7,则HA是弱酸
(2)否; c(A-)=c(Na+)
(3)弱; c(Na+)>c(A-)>c(OH-)>c(H+)
(4)10-5 ;10-5-10-9; 10-9
本题解析:
本题难度:一般
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH)
C.常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<②
D.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)═c(OH-)+c(A-)
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列叙述错误的是
[? ]
A.把a?L?0.1?mol/L?的CH3COOH溶液与b?L?0.1?mol/L的?KOH溶液混合,所得溶液中一定存在:c?(K+)+?c?(H+)?=?c?(CH3COO-)?+?c?(OH-)
B.把0.1?mol/L?的NaHCO3溶液与0.3?mol/L?的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c?(OH-)?>c?(Ba+)>c?(Na+)>?c?(H+)
C.向1?mol/L?的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
参考答案:C
本题解析:
本题难度:一般