| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《离子方程式的书写及正误判断》试题特训(2017年最新版)(二)
参考答案: 本题解析: 本题难度:一般 2、选择题 下列离子方程式正确的是( ) |
参考答案:
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是: ( )
A.H2O2与用硫酸酸化的高锰酸钾混合:2MnO4-+H2O2+6H+=2Mn2++4H2O+3O2
B.过量的Na2S溶液与FeCl3溶液反应:S2-+2Fe3+=S+2Fe2+
C.将1mol/L的NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
D.恒温下向饱和碳酸钠溶液中通入过量二氧化碳:CO2+H2O+CO32-=2HCO3-
参考答案:C
本题解析:A.H2O2与用硫酸酸化的高锰酸钾混合:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,A错误;B.过量的Na2S溶液与FeCl3溶液反应生成S、FeS,即3S2-+2Fe3+=S+2FeS↓,B错误;C.将1mol/L的NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合,二者的 物质的量之比是2:3,所以生成氢氧化铝、氯化钠和氯化铝:即6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+,C正确;D.恒温下向饱和碳酸钠溶液中通入过量二氧化碳生成碳酸氢钠沉淀,即2Na++CO2+H2O+CO32-=2NaHCO3↓,D错误,答案选C。
考点:考查离子方程式的正误判断
本题难度:一般
4、实验题 (15分)亚氯酸钠(NaClO2 )是一种高效漂白剂和强氧化剂。某兴趣小组以NaClO3制取ClO2气体,再由ClO2制得NaClO2,实验装置如下: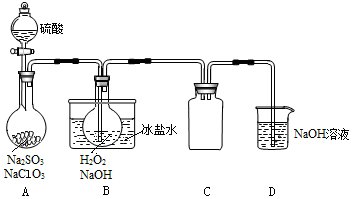
回答下列问题:
(1)用NaOH固体配制约20%的NaOH溶液100mL,需要的仪器有烧杯、玻璃棒、 、 。
(2)实验须使NaClO3稍微过量,目的是 。
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 。
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,则另一种为 。
(5)B中反应的离子方程式为 。
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2,加入 (填序号,下同)酸化,再加入 检验。
①稀HNO3
②稀H2SO4
③K2SO3溶液
④BaCl2溶液
⑤FeCl2溶液
⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9 g NaClO2·3H2O(式量:144.5),至少需 g NaClO3(式量:106.5)。
参考答案:(15分)
(1)量筒、天平 2分
(2)使Na2SO3完全反应,避免产生SO2气体 2分
(3)控制硫酸的滴入速度 2分
(4)ClO3— 2分
(5)H2O2+2OH—+ 2ClO2= 2ClO2—+O2+2 H2O 3分
(6)② 1分
⑤⑥ 1分
(7)26.6
本题解析:(1)用固体配制一定质量分数的溶液需要的仪器有烧杯、玻璃棒、量筒、天平;
(2)亚硫酸钠与氯酸钠在酸性条件下反应生成ClO2,若氯酸钠不过量,则亚硫酸钠会与硫酸反应生成二氧化硫气体,所以氯酸钠过量的原因是使Na2SO3完全反应,避免产生SO2气体;
(3)为使ClO2气体能被均匀、充分吸收,则产生气流的速度不宜过快,所以需控制滴加硫酸的速度;
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2—,Cl元素的化合价从+4价降低到+3价,得到一个电子,则另一种产物中Cl元素的化合价应升高1价为+5价,所以另一种阴离子中Cl元素的化合价是+5价,为ClO3-;
(5)B为制取NaClO2的反应,Cl元素的化合价降低,则过氧化氢中O元素的化合价升高到0价,所以有氧气生成,则B中反应的离子方程式是H2O2+2OH—+ 2ClO2= 2ClO2—+O2+2 H2O;
(6)证明NaClO2具有氧化性,需加入还原剂,因为硝酸具有强氧化性,所以选择酸化的酸应是硫酸,选择②;亚硫酸钠与氯化亚铁均可作还原剂,但亚硫酸钠若被氧化则氧化产物为硫酸根离子,无明显现象,所以选择氯化亚铁,亚铁离子被氧化为铁离子,可用KSCN溶液检验,所以选择⑤⑥。
考点:考查物质制备实验,仪器、试剂的选择,离子方程式的书写
本题难度:困难
5、选择题 下列离子方程式书写正确的是( )
A.向50 mL 1 mol·L-1明矾溶液中滴入数滴0.1 mol·L-1Ba(OH)2溶液
Al3++2SO42-+2Ba2++3OH- ="==" Al(OH)3↓+2BaSO4↓
B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I- ="==" 3I2+2H2O
C.a mol FeBr2溶液中通入a mol Cl2:2Fe2++2Br-+2Cl2 = Br2+2Fe3++4C1-
D.在澄清石灰水中加入适量碳酸氢镁溶液:Ca2++ OH-+ HCO3- ="=" CaCO3↓+H2O
参考答案:C
本题解析:A项KAl(SO4)2 0.05mol,Ba(OH)2 0.1mol反应,Al3+应该变成AlO2-,B项电荷不守恒,D项还应该有Mg(OH)2生成。所以C正确,答案选C。
考点:离子方程式正误判断
点评:离子方程式正误判断要注意:看是否符合客观事实、看是否符合质量守恒、看是否符合电荷守恒、看是否符合得失电子相等。可溶的易电离的物质拆成离子。注意过量、少量、适量等。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《电解质溶液.. | |