| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《弱电解质电离平衡》高频考点强化练习(2017年最新版)(九)
2、选择题 下列说法中正确的是 3、填空题 (12分)Ⅰ.(1)AgNO3的水溶液呈?(填“酸”、“中”、“碱”)性,常温时的pH ?7(填“>”、“=”、“<”),原因是(用离子方程式表示):?;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以? ________(填“促进”、“抑制”)其水解。 4、选择题 下表是不同pH环境时某浓度铬酸(H2CrO4)溶液中,离子浓度(mol/L)与pH的关系,下列说法错误的是
A.铬酸第一级电离方程式为H2CrO4 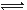 H++HCrO4— H++HCrO4—B.要得到CrO42—应控制溶液的pH>9? C.当电离达到平衡时,2v(正)(HCrO4—)= v(逆)(Cr2O72—) D.该铬酸溶液的物质的量浓度约为1.00mol/L? 5、填空题 一般较强酸可制取较弱酸,这是复分解反应的规律之一.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
A.CH3COOH+NaCN═CH3COONa+HCN B.CO2+H2O+2NaClO═Na2CO3+2HClO C.2HCN+Na2CO3-→2NaCN+CO2+H2O D.Na2CO3+C6H5OH-→NaHCO3+C6H5ONa E.CO2+H2O+C6H5ONa-→NaHCO3+C6H5OH ②已知HA、H2B是两种弱酸,存在以下关系:H2B(少量)+2A-=B2-+2HA,则A-、B2-、HB-三种阴离子结合H+的难易顺序为______. (2)一些复分解反应的发生还遵循其他规律.下列变化都属于复分解反应: ①将石灰乳与纯碱溶液混合可制得苛性钠溶液 ②向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打固体?③蒸发KCl和NaNO3的混合溶液,首先析出NaCl晶体.根据上述反应,总结出复分解反应发生的另一规律为______. (3)常温下某电解质溶解在水中后,溶液中的c(H+)=10-9mol.L-1,则该电解质可能是______(填序号). A.?CuSO4?B.?HCl?C.?Na2S?D.NaOH?E.K2SO4 (4)常温下,将pH=3的盐酸a?L分别与下列三种溶液混合,结果溶液均呈中性. ①浓度为1.0×l0-3mol.L-1的氨水b?L; ②c(OH?-)=1.0×10-3mol.L-l的氨水c?L; ③c(OH-)=1.0×10-3mol?L-1的氢氧化钡溶液d?L. 则a、b、c、d之间由大到小的关系是:______. (5)一定温度下,向等体积等物质的量浓度的下列三份溶液:①NaOH、②CH3COOH、③CH3COONa分别加等量水,pH变化最小的是______(填编号).一定温度下,向等体积纯水中分别加入等物质的量的CH3COONa和NaCN,两溶液中阴离子的总物质的量分别为n1和n2,则n1和n2的关系为n1______n2(填“>”、“<”或“=”). (6)己知常温时Ksp(AgCl)=1.8×10-10mol2.L-2,向50mL?0.018mo1.L-l的AgNO3溶液中加入相同体积0.020mol.L-1的盐酸,则c(Ag+)=______,此时所得混合溶液的pH=______. |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学实验的.. | |