微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温时,将pH=3的盐酸和pH=11的氨水等体积混合后,所得的溶液pH( )
A.等于7
B.大于7
C.小于7
D.无法确定
参考答案:pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,则所得溶液的pH>7,
故选B.
本题解析:
本题难度:一般
2、选择题 足量的二氧化碳通入到1mol/LNaOH溶液中,下列说法错误的是
[? ]
A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数)
B.溶液中的CO32-离子浓度先增大后减小
C.微热反应后的溶液,溶液的pH会升高
D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系:c?(Na+)?+?c?(H+)?=c?(HCO3-)?+2?c?(CO32-)?+?c?(OH-)
参考答案:A
本题解析:
本题难度:一般
3、选择题 pH = 2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c = 0.1 mol/L)至pH = 7。消耗NaOH溶液的体积为Vx、Vy,则
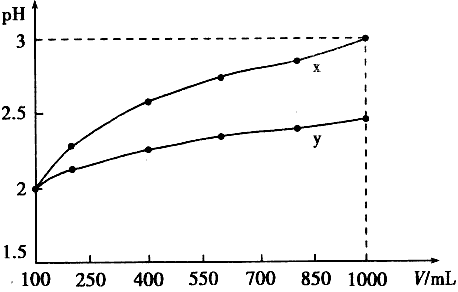
[? ]
A.x为弱酸,Vx<Vy?
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy?
D.y为强酸,Vx>Vy
参考答案:C
本题解析:
本题难度:一般
4、选择题 给试管中某红色溶液加热,溶液颜色逐渐变浅,则原溶液可能是
①滴有石蕊的NH4Cl溶液?②滴有酚酞的氨水溶液?③滴有石蕊的H2SO4溶液?④滴有酚酞的饱和氢氧化钙溶液?⑤滴有酚酞的Na2CO3溶液?⑥溶有SO2的品红溶液
A.②④
B.①③⑤
C.①④⑥
D.②③
参考答案:A
本题解析:① NH4Cl是强酸弱碱盐,在溶液中NH4+水解是溶液呈酸性,所以滴加石蕊试液溶液变为红色。由于盐水解反应是吸热反应,所以升高温度,NH4Cl水解程度增大,溶液的酸性增强,溶液红色逐渐加深。错误。②氨水显碱性,滴加酚酞溶液变为红色。给试管加热,由于氨水不稳定,受热容易分解,氨气逸出,溶液的碱性减弱,所以红色变浅。正确。③H2SO4溶液是酸性的,能使紫色石蕊试液变为红色。由于它是强电解质,稳定性强。加热时既不分解,也不再电离,所以溶液的红色不变。错误。④氢氧化钙是强碱,能使无色的酚酞变为红色,但其溶解度随温度的升高而降低,所以给试管中的时饱和氢氧化钙溶液加热时由于溶解度的减小c(OH-)降低,溶液的碱性减弱,所以红色变浅。正确。⑤Na2CO3是强碱弱酸盐水解使溶液显碱性所以滴加酚酞试液变为红色。由于升高温度促进盐的水解,所以加热试管时红色变深。错误。⑥品红溶液是红色的,当其中溶有SO2的时候,由于SO2有漂白性,所以溶液呈无色。该无色物质不稳定,受热容易分解。所以给试管中的物质加热时溶液又变为红色。错误。
本题难度:一般
5、选择题 下列各组数据中,其比值为2:1的是( )
A.相同温度下,0.2mol?L-1乙酸溶液与0.1mol?L-1乙酸溶液中c(H+)之比
B.氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH+4):c(SO2-4)
C.Na2CO3溶液中,c(Na+):c(CO2-3)
D.pH=12的BA(OH)2溶液与pH=12的KOH溶液中,c[BA(OH)2]:c(KOH)
参考答案:A、弱酸的电离程度规律:越稀越电离,相同温度下,0.2mol?L-1乙酸溶液的电离程度不如0.1mol?L-1乙酸溶液的电离程度大,所以两溶液中c(H+)之比小于2:1,故A错误;
B、pH=7的溶液中,溶液显中性,则溶液中的氢离子和氢氧根浓度相等,根据电荷守恒:c(H+)+c(NH+4)=2c(SO2-4)+c(OH-),所以c(NH+4):c(SO2-4)=2:1,故B正确;
C、Na2CO3溶液中,碳酸根是弱离子,在溶液中会水解,所以c(Na+):c(CO2-3)>2:1,故C错误;
D、pH=12的Ba(OH)2溶液中,氢氧根浓度为0.01mol/L,所以与pH=12的KOH溶液中,c[Ba(OH)2]=0.005mol/L,pH=12的KOH溶液中,氢氧根浓度为0.01mol/L,c(KOH)=0.01mol/L,所以c[Ba(OH)2]:c(KOH)=1:2,故D错误.
故选B.
本题解析:
本题难度:一般