微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大。其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g·L—1,C元素原子的最外层电子数是其内层电子数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):
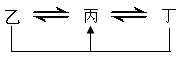
其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、
丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应。请回答下列问题:
(1)写出化合物甲的电子式:??。
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式?;
写出均含有F元素的乙与丁在溶液中发生反应的离子方程式??。
(3)由A、C元素组成化合物的戊和A、E元素组成的化合物己,式量均为34。其中戊的熔沸点高于己,其原因是:?。
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐。请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式?。该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体。写出相关反应的化学方程式?,析出该复盐晶体的原理是? ?。
参考答案:(1)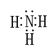 (1分)
(1分)
(2)3NH3·H2O+Al3+=Al(OH)3↓+3NH4+(2分)? Fe+2Fe3+=3Fe2+(2分)
(3)H2O2分子间存在氢键? (2分)
(4)(NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2·6H2O或(NH4)2SO4 ·FeSO4·6H2O? (2分)?
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2·6H2O? (2分)
?硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多 (2分)
本题解析:A元素原子核内只有一个质子,则A是氢元素。标准状况下的密度为0.759g·L—1,则相对分子质量是0.759×22.4=17,所以是氨气,即B是氮元素。C元素原子的最外层电子数是其内层电子数的3倍,所以C是氧元素。E与C同主族,则E是硫元素。D、F为常见金属元素,且均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应,所以D是铝。均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应,则F是铁元素。
(1)氨气含有极性键,电子式为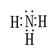 。
。
(2)氨水和铝离子反应生成氢氧化铝沉淀,方程式为3NH3·H2O+Al3+=Al(OH)3↓+3NH4+。含有铁元素的乙与丁分别是铁和铁离子,方程式为Fe+2Fe3+=3Fe2+。
(3)戊和己分别是双氧水和硫化氢,由于双氧水中含有氢键,所以沸点高于硫化氢的。
(4)A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式为(NH4)2Fe(SO4)2。根据反应物和生成物可知,方程式为(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2·6H2O。由于?硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多,所以会形成晶体。
本题难度:一般
2、选择题 某元素X的阳离子和Y元素的阴离子具有与氖原子相同的电子层结构,正确是
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高正价比一定比Y的小
参考答案:C
本题解析:略
本题难度:一般
3、填空题 (13分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
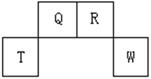
(1)W在周期表中的位置是?, Q、R、T三种元素原子的半径从大到小排列顺序?(用元素符号表示),Q的最高价氧化物的电子式?,R气态氢化物分子的结构式为?;
(2)元素的原子得电子能力:Q?W(填“强于”或“弱于”);
(3)原子序数比R多8的元素形成的一种常见气态氢化物的沸点?(填“高”或“低”)于R的的常见气态氢化物;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是?(填名称);
(5)现有8种元素的性质、数据如下表所列,它们属于短周期:请指出R元素在下表中的对应编号?,与T同周期且最高价氧化物的水化物碱性最强的元素在下表中的对应编号?。
?
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
|
原子半径(10-10m)
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.6
| 0.75
| 0.82
|
最高或最低化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
| +3
|
-2
| ?
| ?
| -3
| -1
| ?
| -3
| ?
参考答案:(1)第3周期ⅥA族(2分) Al>C>N (用元素符号表示)(2分)
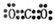 (2分) (2分) 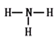 (2分)?(2)弱于(1分)?(3)低(1分) (2分)?(2)弱于(1分)?(3)低(1分)
(4)金刚石(填名称)(1分)?(5)⑦(1分) ?⑥(1分)
本题解析:图中所示是短周期元素Q、R、T、W在元素周期表中的位置,因为T所处的周期序数与主族族序数相等,所以可以知道T是Al,则Q是C,R是N,W是S,则
(1)硫元素的原子序数是16,在周期表中的位置是第三周期第ⅥA族;同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则Q、R、T三种元素原子的半径从大到小排列顺序Al>C>N。碳元素的最高价氧化物是CO2,含有极性键的共价化合物,电子式 。氮元素气态氢化物分子是氨气,其结构式为 。氮元素气态氢化物分子是氨气,其结构式为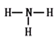 ; ;
(2)同周期自左向右非金属性逐渐增强,同主族自上而下非金属性逐渐减弱,则元素的原子得电子能力:碳元素弱于硫元素;
(3)原子序数比R多8的元素是磷元素,形成的一种常见气态氢化物是PH3,由于氨气分子间存在氢键,因此PH3的沸点低氨气的沸点;
(4)T、Q、R、W的单质中,固态时属于原子晶体的是金刚石;
(5)①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,因此氮元素在下表中的对应编号是⑦,与T同周期且最高价氧化物的水化物碱性最强的元素是钠,在下表中的对应编号是⑥。
本题难度:一般
4、选择题 当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
参考答案:A
本题解析:1s22s22p63s2为基态电子排布,1s22s22p63p2为激发态电子排布。由基态变为激发态是需要吸收能量的,因此A正确,B错误。根据洪特规则电子优先占据一个轨道,且自旋方向相同,C错。电子由基态变为激发态,并没有影响电子层结构,D错。所以正确的选项为A。
点评:根据构造原理、泡利原理和洪特规则,能量最低排布的就是基态电子排布,能量不是最低的排布就是激发态电子排布。
本题难度:一般
5、计算题 3.2 g某元素A 的单质与氢气化合生成3.4 g气态氢化物H2A,已知A 的原子核中质子数和中子数相等,则:
(1) A的原子序数为?(2分)
(2) 元素A位于元素周期表中什么位置?(2分)
(3) 气态氢化物的化学式是什么?并书写气态氢化物的电子式(2分)
参考答案:
本题解析:略
本题难度:一般
|