微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是(?)

A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
参考答案:C
本题解析:根据L、Q的主要化合价为+2价及两者的半径大小关系可知,L、Q分别为ⅡA族的Mg与Be,单质与稀盐酸反应的速率Mg>Be,B错;根据R、T的负价均为-2价和两者的原子半径关系可知,T为O元素,R为S元素,气态氢化物的稳定性H2O>H2S,A错;M的正价为+3价,且原子半径在Mg与S之间,故M为Al,Al2O3具有两性,C对;Mg2+与S2-的核外电子数不相等,D错。
本题难度:一般
2、填空题 根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,在元素周期表中的位置是____________________。
(2)C元素基态原子的电子排布图是下图中的_______(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合_______(从A B C中选择)。
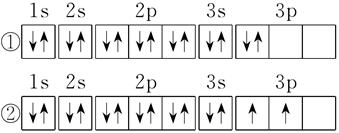
A.能量最低原理? B.泡利原理? C.洪特规则
(3)依据正负化合价代数和等于0,H元素可以放在周期表中的?族
(4)氯化铵的电子式?
参考答案:(10分) (1) 铬 第四周期、第ⅥB族, (2) ② C (3) ⅣA (4)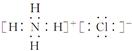
本题解析:(1)根据核外电子的排布式可知,1~36号元素原子核外电子排布中未成对电子数最多的元素是铬,位于第四周期第ⅥB族。
(2)在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同,这就是洪特规则,显然①不符合洪特规则,正确第排布图是②。
(3)依据正负化合价代数和等于0可知,H元素的最高价是+1价、最低价是-1价,所以氢元素可以放在周期表中的ⅣA族。
(4)氯化铵是含有离子键的离子化合物,电子式是 。
。
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础性知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
3、选择题 2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的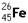 原子,有关
原子,有关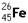 的说法正确的是(?)
的说法正确的是(?)
A.它是一种新元素
B.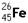 与
与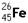 互为同素异形体
互为同素异形体
C.它是一种新原子
D.这种铁原子的中子数是26
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列叙述正确的是
A.2s轨道可以和3p轨道形成sp2杂化轨道
B.烯烃中的碳碳双键由l个σ键和l个π键组成
C.由极性键组成的分子,一定是极性分子
D.甲烷中心原子sp3杂化轨道有一个由孤电子对占据
参考答案:B
本题解析:A:能量相近轨道才可以杂化,不正确
B:正确
C:如果分子对称性好,极性键组成的分子也可能是非极性的分子
D:甲烷中心原子sp3杂化轨道中每个轨道有一个电子,没有孤对电子
答案为B
本题难度:一般
5、选择题 A、B分别为第三、四两周期同一主族的不同元素
的原子,它们原子核内的质子数等于中子数。①若
A为IIA族,其质量数为X,则B的质子数为Y。②若A为IV A族,其质子数为m,则B的质量数为n,则Y和n的值是?(?)
A.(x/2+18)和(2m+18)? B.(x/2+8)和(2m+18)
C.(x/2+8)和(2m+36)? D.(x/2+18)和(2m+36)
参考答案:C
本题解析:本题考查元素周期表的结构知识。注意掌握第三周期和第四周期同主族元素之间原子序数(质子数)相差8或18,即可作出正确判断。
本题难度:一般