微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于晶体与非晶体的说法正确的是
[? ]
A.晶体一定比非晶体的熔点高
B.晶体有自范性但排列无序
C.非晶体无自范性而且排列无序
D.固体SiO2一定是晶体
参考答案:C
本题解析:
本题难度:简单
2、选择题 如图是CaF2晶胞的结构。下列说法正确的是
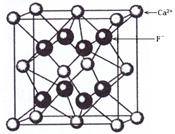
A.一个CaF2晶胞中含有8个Ca2+
B.一个CaF2晶胞中含有8个F-
C.在CaF2晶胞中Ca2+的配位数为4
D.在CaF2晶胞中F-的配位数为8
参考答案:B
本题解析:根据晶胞结构可知,一个CaF2晶胞中含有的Ca2+和F-的个数分别为8×1/8+6×1/2=4,8×1=8,所以A不正确,B正确。配位数是指一个离子周围最邻近的异电性离子的数目。所以根据晶胞的结构可判断Ca2+的配位数是8,F-的配位数是4,即选项CD都是错误的。答案选B。
本题难度:一般
3、填空题 (1)下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

①请写出图中b单质对应元素原子的电子排布式________________
②单质a、f对应的元素以1:1的原子个数比形成的分子(相同条件下对H2的相对密度为13)中含___个σ 键和___个π键。
③a与b元素形成的10电子中性分子X的空间构型为___________,将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络合离子的化学式为__________,其中X与Ag+之间以__________键结合。
④下图是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_____________________

(2)碳是形成化合物最多的元素,其单质与化合物广泛存在于自然界中。
①与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是____________。
②CS2是一种重要的有机溶剂,写出一种与CS2互为等电子体的阴离子的化学式:____________。
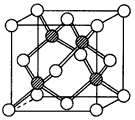
③冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如下图,所有球表示的微粒相同。其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有
____个水分子, 若冰晶胞的边长为acm,阿伏加德罗常数为NA,冰的密度为d g/cm3,则水的摩尔质量为___________。
参考答案:(1)①1s22s22p3;②3;2;③三角锥形;[Ag(NH3)2]+;配位;④HNO3是极性分子,易溶于极性的水中,
HNO3分子中的-OH易与水分子之间形成氢键
(2)①N原子2p轨道半充满,能量低;②N3-;③8;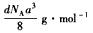
本题解析:
本题难度:一般
4、填空题 PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
(1)PtCl2(NH3)2是平面正方形结构,还是四面体结构_______________
(2)请在以下空格内画出这两种固体分子的几何构型图,
淡黄色固体:______________,黄绿色固体:_______________
(3)淡黄色固体物质是由_______________分子组成,黄绿色固体物质是由_______________分子组成(填“极性分子”或“非极性分子”)
(4)黄绿色固体在水中溶解度比淡黄色固体大,原因是_______________
参考答案:(1)平面正方形
(2)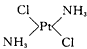 ;
;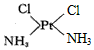
(3)非极性;极性
(4)根据相似相溶原理,因为淡黄色固体为非极性分子,所以在水中的溶解度小,而黄绿色固体为极性分子,所以在水中的溶解度大
本题解析:
本题难度:一般
5、填空题
|
1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5°。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这个电子。请回答

(1)臭氧与氧气的关系是______________
(2)写出下列分子与O3分子的结构最相似的是______________
A.H2O B.CO2 C.SO2 D.BeCl2
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_________对孤对电子。
(4)O3分子是否为极性分子______________。(填是或否)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
①_____PbS +_____O3 ====_______PbSO4 +______O2
②生成1mol O2的转移电子物质的量为__________mol。
参考答案:(1)同素异形体
(2)C?
(3)5
(4)是
(5)①1、4、1、4;②2
本题解析:
本题难度:一般