微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质属于离子化合物的是(? )
A.NaOH
B.CO
C.Br2
D.H2SO4
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列分子是含有极性共价键的非极性分子的是
[? ]
A.H2O
B.CS2
C.NH3
D.H2
参考答案:B
本题解析:
本题难度:简单
3、填空题 (14分).下表是部分短周期元素的原子半径及主要化合价:
元素代号
| W
| R
| X
| Y
| Z
| Q
| M
|
原子半径/nm
| 0.037
| 0.186
| 0.074
| 0.075
| 0.077
| 0.110
| 0.160
|
主要化合价
| +1
| +1
| -2
| -3,+5
| +2,+4
| -3,+5
| +2
|
?试回答下列问题:
(1)七种元素中原子半径最大的元素在周期表中位置是?。M在Z的最高价氧化物中燃烧的化学方程式为?。
(2)?元素Z可形成多种同素异形体,其中有属于原子晶体的,写出它的名称?
(3)X可与R按1:l的原子个数比形成离子化合物甲,甲中存在的化学键有?;X可与w组成含18电子的共价化合物乙,则乙的电子式为?。
(4)M的最高价氧化物的水化物难溶于水,已知298K时,该物质的的KSP=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的M离子物质的量浓度为?mol·L-1。
(5)向含4mol Y的最高价氧化物对应的水化物的稀溶液中,逐渐加入铁粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(Fe2+)随n(Fe )变化的示意图,并标出n(Fe 2+)的最大值。
参考答案:(14分).(1)第三周期IA族;? 2Mg+CO2==2MgO+C?
(2)金刚石
(3)离子,共价键;?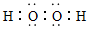
(4)5.6×10—10? mol/L
本题解析:W、R、X、Y、Z、Q、M对应元素分别为H、Na、O、N、C、P、Mg;
(1)七种元素中原子半径最大的元素是Na,位于周期表中第三周期,IA族;Z的最高价氧化物为CO2,其反应方程式为:2Mg+CO2=====2MgO+C;
(2)元素碳可形成多种同素异形体,其中有属于原子晶体的为:金刚石;
(3)X可与R按1:l的原子个数比形成离子化合物甲为Na2O2,存在离子键、非极性键;X可与w组成含18电子的共价化合物乙为H2O2;电子式为: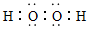 ;
;
(4)5.6×10—10? mol/L
(5)铁与硝酸反应的方程式为: ,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应:
,1mol铁与4mol硝酸恰好完全反应生成1mol +3铁,再加入铁则发生反应: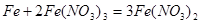 ;1mol +3铁完全反应后生成1.5mol+2铁;则
;1mol +3铁完全反应后生成1.5mol+2铁;则
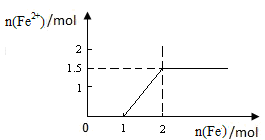
本题难度:一般
4、填空题 . (6分)碳族元素包括C、Si、Cu、Sn、Pb。
(1)碳纳米管由单层或多层石墨卷曲而成,其结构类似于石墨晶体,每个碳原子通过?杂化与周围碳原子成键,多层碳纳米管的层与层之间靠?结合在一起。
(2)CH4中共用电子对偏向C、SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为?。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br键的键角?120°(填“>”“<”或“=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为?,每个Ba2+与?个O2-配位。
参考答案:(每空1分,共6分)(1)sp2?分子间作用力(或:范德华力)
(2)C>H>Si?(3) ?(4)BaPbO3? 12
?(4)BaPbO3? 12
本题解析:(1)石墨属于层状结构,同一层内碳元素是通过sp2杂化与其它碳原子成键。而层与层之间通过分子间作用力结合在一起。
(2)元素电负性越强,共用电子对就偏向该原子不少于根据题意可知,C、Si、H的电负性由大到小的顺序为C>H>Si 。
(3)根据价层电子对互斥理论可知,中心原子含有的孤对电子是(4-1×2)÷2=1,所以其键角小于120°。
(4)Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,所以每个Ba2+与12个O2-配位,则晶胞中Pb4+的个数为8×1/8=1、Ba2+是1个、O2-是12×/14=3,所以化学式为BaPbO3。
本题难度:一般
5、选择题 能够用键能的大小作为主要依据来解释的是
[? ]
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C.稀有气体一般难于发生化学反应
D.空气中氮气的化学性质比氧气稳定
参考答案:D
本题解析:
本题难度:简单