微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 实验室用图示装置制取乙酸乙酯。
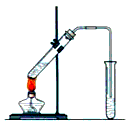
(1)浓H2SO4的作用是:①_____________,②_____________。
(2)右边收集试管内装有_____________,该溶液的作用是_____________________________________。 导气管不能插入液面以下,原因是_____________。加热前,大试管中加入几粒碎瓷片的作用是___________________________。
(3)制取乙酸乙酯的反应方程式是________________________。
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是
_________________。
参考答案:(1)催化剂;脱水剂(或吸水剂)
(2)饱和碳酸钠溶液;除去挥发出来的乙酸和乙醇,减小乙酸乙酯溶解度,有利于分层; 防止倒吸;防止暴沸
(3)CH3COOH+CH3CH2OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
(4)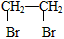
本题解析:
本题难度:一般
2、实验题 实验室在蒸馏烧瓶中加NaBr、适量水、95%的乙醇和浓H2SO4,边反应边蒸馏,蒸出的溴乙烷用水下收集法获得。化学反应方程式为 NaBr+H2SO4=NaHSO4+HBr; C2H5OH+HBr C2H5Br+H2O
C2H5Br+H2O
其中可能发生的副反应有 2HBr+H2SO4(浓)=Br2 +SO2↑+2H2O 已知CH3CH2Br的沸点为38.4℃,密度比水大,常温 下为不溶于水的油状液体。 请回答下列问题:
(1)反应中加入适量的水,除溶解NaBr外,作用还 有①_________;②____________。
(2)为了保证容器均匀受热和控制恒温,加热方法 最好采用___________。
(3)烧瓶中的导气管在瓶塞上的垂直部分比其他同 种装置中的导管要长些的原因是___________。
(4)本实验是否需要采用边反应边蒸馏的操作?_____________。
(5)溴乙烷可用水下收集法获得的依据和从水中分 离的方法是________。
参考答案:(1)①吸收HBr? ;②稀释浓硫酸,降低其氧化性,减少副产物
(2)水浴加热
(3)冷凝回流,减少反应物的损失,增大溴乙烷的浓度
(4)需要
(5)溴乙烷不溶于水且比水密度大,采用分液漏斗分液
本题解析:
本题难度:一般
3、填空题 实验室制取氢氧化铁胶体的方法是____________,可用______________(方法)证明胶体已经制成。
参考答案:向沸腾的水中滴加少量氯化铁饱和溶液,并继续煮沸至液体呈褐色;丁达尔效应
本题解析:
本题难度:一般
4、简答题 绿矾(FeSO4?7H2O)是治疗缺铁性贫血药品的重要成分.下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
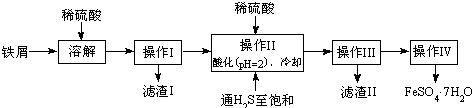
查询资料,得有关物质的数据如下表:
| 25℃时 | pH值
饱和H2S溶液
3.9
SnS沉淀完全
1.6
FeS开始沉淀
3.0
FeS沉淀完全
5.5
|
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为______.
A.KSCN溶液?B.NaOH溶液?C.KMnO4溶液?D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是______;在溶液中用硫酸酸化至pH=2的目的是______.
(3)操作IV的顺序依次为______、冷却结晶、______.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②______.
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①滴定时盛放KMnO4溶液的仪器为______(填仪器名称).
②判断此滴定实验达到终点的方法是______.
③计算上述样品中FeSO4?7H2O的质量分数为______.
参考答案:(1)检验所得绿矾晶体中是否含有Fe3+的实验操作是利用三价铁离子检验方法分析,三价铁离子遇硫氰酸根离子会反应生成硫氰酸铁血红色,证明铁离子的存在,
A、KSCN溶液和三价铁离子反应生成血红色溶液,可以检验铁离子的检验,故A符合;
B、NaOH溶液和亚铁离子反应生成白色沉淀迅速变化为灰绿色最后变为红褐色,和铁离子反应生成红褐色沉淀,不能检验铁离子的存在,故B不符合;
C、KMnO4溶液不与铁离子反应物现象发生,故C不符合;
D、苯酚溶液和铁离子反应生成紫色溶液,可以检验铁离子的存在,故D符合;
故答案为:AD;
(2)通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化,已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液PH=2时,Sn2+完全沉淀,亚铁离子不沉淀,
故答案为:除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀;
(3)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发、结晶、过滤、洗涤,
故答案为:蒸发浓缩;过滤洗涤;
(4)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失,故答案为:降低洗涤过程中FeSO4?7H2O的损耗;
(5)①高锰酸钾溶液具有强氧化性能氧化橡胶管,不能用简式滴定管,用酸式滴定管,故答案为:酸式滴定管;
②滴定实验达到终点时,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色,故答案为:滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL,则
? 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
? 5? ?1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;
则250mL溶液中含Fe2+=0.001mol×25025=0.01mol;
FeSO4?7H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;
质量分数=2.78g2.85g×100%=97.54%,
故答案为:97.54%.
本题解析:
本题难度:一般
5、实验题 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。
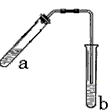
(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序用操作是__________ 。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是___________ 。
(3)实验中加热试管a的目的是: ①__________ ; ② __________;
(4)试管b中加有饱和Na2CO3溶液,其作用是 _____。
(5)反应结束后,振荡试管b,静置。观察到的现象是 __________ 。
参考答案:(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加入冰醋酸
(2)在试管a中加入几粒沸石(或碎瓷片)
(3)①加快反应速率; ②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动?
(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇?
(5)b中的液体分层,上层是透明的油状液体
本题解析:
本题难度:一般