微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,向0.1 mol/L的CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系c(Na+) + c(OH-) = c(H+)+ c(CH3COO-),则下列叙述正确的是
A.混合溶液中:c(OH-) >c(H+)
B.混合溶液中:c(CH3COO-)=" 0.1" mol/L
C.混合溶液中:c(Na+) > c(CH3COO-)
D.混合溶液中:c(Na+) = c(CH3COO-)
参考答案:D
本题解析:根据电荷守恒可知c(Na+) + c(H+) =c(OH-) + c(CH3COO-),又因为c(Na+) + c(OH-) = c(H+)+ c(CH3COO-),所以一定有c(Na+) = c(CH3COO-),答案选D。
本题难度:简单
2、选择题 下列热化学方程式中,△H能表示对应物质的标准燃烧热的是
A.CO(g)+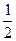 O2(g)==CO2(g)△H =-283.0 kJ?mol—1
O2(g)==CO2(g)△H =-283.0 kJ?mol—1
B.C(s)+ 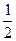 O2(g)="=CO(g)" △H = -110.5 kJ?mol—1
O2(g)="=CO(g)" △H = -110.5 kJ?mol—1
C.H2(g)+ 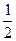 O2(g)==H2O(g)△H = -241.8 kJ?mol—1
O2(g)==H2O(g)△H = -241.8 kJ?mol—1
D.2C8H18O(l)+25O2(g)==16CO2(g)+18H2O(l)△H =-11828.0 kJ?mol—1
参考答案:
本题解析:略
本题难度:简单
3、选择题 下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是(?)
A.CH3COOH
B.Al2(SO4)3
C.NaOH
D.Na2CO3
参考答案:B
本题解析:影响水的电离平衡的外界条件有:温度、溶液酸碱性、盐类水解等。将CH3COOH加入水中,则增大水中的[H+],从而会抑制水的电离,减小了的电离程度,但是由于CH3COOH的电离,溶液呈酸性。NaOH的加入,则增大水中的[OH-],从而会抑制水的电离,减小了水的电离程度,溶液呈碱性。B、D都是盐类,并且一个是强酸弱碱盐,一个是强碱弱酸盐,把它们加入到水中,都会发生水解,结合水电离产生的OH-和H+,使平衡向电离的方向移动,从而会促进水的电离。
本题难度:简单
4、选择题 一些烷烃的燃烧热(KJ/mol)如表:
| 化合物 | 燃烧热 | 化合物 | 燃烧热
甲烷
891.0
正丁烷
2878.0
乙烷
1560.8
异丁烷
2869.6
丙烷
2221.5
2-甲基丁烷
3531.3
|
下列表达正确的是( )
A.热稳定性:正丁烷>异丁烷
B.乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)→4CO2(g)+6H2O(g)+1560.8KJ
C.正戊烷的燃烧热大约在3540KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
参考答案:A、由表格中的数据可知,异丁烷的燃烧热比正丁烷的燃烧热小,则异丁烷的能量低,即热稳定性为正丁烷<异丁烷,故A错误;
B、根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为
2C2H6(g)+7O2(g)=4CO2 (g)+6H2O(l);△H=-3121.6kJ/mol,故B错误;
C、正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正丁烷的燃烧热大于2-甲基丁烷,
即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故C正确;
D、相同质量的烷烃,氢的质量分数越大,燃烧放热越多,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 下列溶液一定呈中性的是
A.溶液中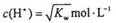 (KW为溶液所处温度时水的离子积常数)
(KW为溶液所处温度时水的离子积常数)
B.pH=7的溶液
C.使石蕊试液呈紫色的溶液
D.等体积0.1 mol·L-1硫酸与0.1 mol·L-1的氢氧化钠溶液混合后的溶液
参考答案:A
本题解析:B项:在常温下,pH=7的溶液呈中性,如其它温度,则不呈中性,故错;C项:使石蕊试液呈紫色的溶液,不一定呈中性,在常温下,pH=5~8都是紫色的,故错;D项:酸的量多,最终溶液呈酸性,故错。故选A。
点评:本题考查的是溶液的酸碱性的判断,题目难度适中,需要注意的是在中性溶液中,c(H+)=c(OH-)。
本题难度:简单