|
高考化学知识点整理《键参数——键能、键长与键角》考点强化练习(2017年押题版)(六)
2017-09-25 16:42:23
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 配位键是一种特殊的共价键,即共用电子对由某原子单方面提供和另一缺电子的粒子结合。如NH4+就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列粒子中可能存在配位键的是________。
A.CO2
B.H3O+
C.CH4
D.H2SO4
| (2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式:___________________。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了种观点:
甲: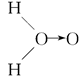 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。 、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)_____________________________________________________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________________________________________________________。
参考答案:(1)BD
(2)H3BO3+H2O H++[B(OH)4]- H++[B(OH)4]-
(3) 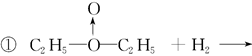 ? ?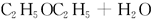
②用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
本题解析:本题综合考查配位键的形成和配合物的性质。解题时要注意配位键形成条件中的一方提供孤对电子,另一方提供空轨道。
(1)由题中信息可导出结论:凡能给出H+的物质中一般含有配位键。
(2)硼原子为缺电子原子,H3BO3的电离实质是B原子和水中的OH-形成配位键,水产生的H+表现出酸性。
(3)由题中所含配位键的物质的反应特点分析。
本题难度:一般
2、选择题 下列叙述正确的是
[? ]
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.在CaO和SiO2晶体中,都不存在单个小分子
D.甲烷的结构式: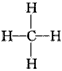 ,是对称的平面结构,所以是非极性分子 ,是对称的平面结构,所以是非极性分子
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列化合物中既有离子键又有共价键的是( )
A.KBr
B.NH4Cl
C.HF
D.O3
参考答案:B
本题解析:
本题难度:简单
4、填空题 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如下图所示。
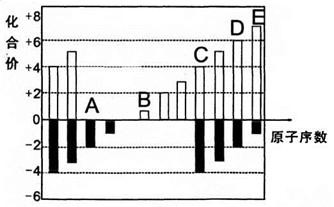
(1)A、B、C、D四种元素中第一电离能最小的是?(填元素名称),其基态原子核外电子排布式是?,
(2)D、E的最高价氧化物的水化物中,酸性较强的是??(写化学式)。
D的氢化物沸点比A的氢化物沸点?(填“高”或“低”)。
(3)化合物CA2的晶体类型是______,CA2与B最髙价氧化物的水化物溶液发生反应的离子方程式是_______
(4)在298K、101.3kPa下,1.6gD单质在足量的氧气中燃烧,放出14.85kJ热量,该反应的热化学方程式是______________
参考答案:(共16分)
(1)钠(2分)? 1s22s22p63s1(2分)?
(2)HClO4(2分)?低?(2分)
(3)原子晶体(2分)? SiO2+2OH-=SiO32-+H2O(3分)
(4)S(s)+O2(g)=SO2(g)?⊿H=" —297.0" kJ·mol-1(3分)
本题解析:有化合价可以推知A、B、C、D、E分别为O、Na、Si、S、Cl。
(1)金属性越强,越易失电子,第一电离能越小,故Na最小;
(2)非金属性越强,最高价氧化物对应水化物的碱性越强,非金属Cl>S,H2O存在氢键,故沸点较高;
(3)SiO2为原子晶体,为酸性氧化物,可以与强碱发生反应;
(4)1.6gS,物质的量为0.05mol,故1molS反应放出的热量为14.85KJ/0.05mol=297.0KJ/mol;从而写出热化学方程式。
本题难度:一般
5、选择题 在一定条件下,下列物质不能与二氧化硅反应的是:
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤硝酸 ⑥氢氧化钠 ⑦硝酸钙
A.③⑤⑦
B.⑤⑦
C.③⑤
D.⑤
参考答案:B
本题解析:考查二氧化硅的化学性质。在高温下二氧化硅可与焦炭、纯碱、碳酸钙反应。常温下能与氢氟酸和氢氧化钠反应。但不能和硝酸及硝酸钙反应。答案是B。
本题难度:简单
|  、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。
、乙:H—O—O—H,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂)。