微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品.某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体
(CuCl2?2H2O).

(1)实验室采用如图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
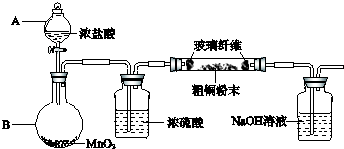
①仪器A的名称是______.
②装置B中发生反应的离子方程式是______.
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)______.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)______.
a.NaOH?b.NH3?H2O?c.CuO?d.Cu2(OH)2CO3?e.CuSO4
(3)在溶液2转化为CuCl2?2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:Cu(H2O)42+(aq)+4Cl-(aq)?

?CuCl42-(aq)+4H2O(l)
?蓝色? ? ?黄色
①上述反应的化学平衡常数表达式是K=______.若增大氯离子浓度,K值(填“增大”、“减小”或“不变”)______.
②取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)______.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失.
参考答案:(1)①仪器A是分液漏斗.
故答案为:分液漏斗.
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl-??△?.??Mn2++Cl2↑+2H2O.
故答案为:MnO2+4H++2Cl-??△?.??Mn2++Cl2↑+2H2O.
③HCl对反应没有影响,不需要在浓硫酸洗气瓶前增加吸收HCl的装置.
故答案为:否.
(2)由工艺流程可知,加入试剂X用于调节pH以除去杂质,且不能引入新杂质.
a.NaOH引入杂质钠离子,故a错误;
b.NH3?H2O?引入铵根离子,故b错误;
c.CuO可以调节PH值,除去杂质,过量的CuO过滤除去,不引入杂质,故c正确;
d.Cu2(OH)2CO3?可以调节PH值,除去杂质,过量的Cu2(OH)2CO3?过滤除去,不引入杂质,故d正确;
e.CuSO4不能调节PH值,引入硫酸根离子,故e错误;
故选:cd.
(3)①Cu(H2O)42+(aq)+4Cl-(aq)?

?CuCl42-(aq)+4H2O(l)的平衡常数为k=c(CuCl2-4)c[Cu(H2O)2+4]?c4(Cl-).
平衡常数只受温度影响,与离子浓度无关,增大氯离子浓度,K值不变.
故答案为:c(CuCl2-4)c[Cu(H2O)2+4]?c4(Cl-);不变.
②a.将Y稀释,平衡向作反应移动,溶液呈蓝色,可以能够证明CuCl2溶液中转化关系,故a正确;
b.在Y中加入CuCl2晶体,溶液中Cu(H2O)42+浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故b正确;
c.在Y中加入NaCl固体,溶液中氯离子浓度增大,平衡向右移动,溶液变为绿色,可以能够证明CuCl2溶液中转化关系,故c正确;
d.取Y进行电解,铜离子放电,溶液颜色最终消失,不能可以能够证明CuCl2溶液中转化关系,故d错误.
故选:abc.
本题解析:
本题难度:一般
2、填空题 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
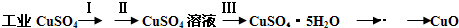
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3
开始沉淀pH
6.0
7.5
1.4
沉淀完全pH
13
14
3.7
|
(1)步骤Ⅰ的目的是除不溶性杂质.所需操作的名称是______.
(2)步骤Ⅱ的目的是除硫酸亚铁.操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①写出用H2O2溶液除去硫酸亚铁的离子方程式______.
②调整pH?的范围应该在______之间.
(3)步骤Ⅲ的目的是得到CuSO4?5H2O晶体.操作是将溶液加热蒸发至有晶膜出现时,停止加热,______,水浴加热烘干.采用水浴加热的原因是______.
(4)该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入?2mL?5%?H2O2溶液,再向H2O2溶液中分别滴入0.1mol?L-1FeCl3和CuSO4?溶液各1mL,摇匀,观察到滴入FeCl3?溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确______(填正确或错误),请说明原因______.
参考答案:(1)除去混合物中不溶性的杂质,可以先溶解、在过滤,在溶解的过程中必须用玻璃棒搅拌,故答案为:溶解、过滤;
(2)①加H2O2将Fe2+氧化为Fe3+,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②加H2O2已将Fe2+氧化为Fe3+,Fe3+只能存在于酸性溶液中,当溶液的pH大于1.4时,Fe3+开始水解生成沉淀,当溶液的pH等于3.7时,Fe3+已完全水解为沉淀,为防止生成Cu(OH),pH应小于6.0,故答案为:3.7~6.0;
(3)将CuSO4溶液加热蒸发至有晶体析出现时,即饱和状态,停止加热,冷却结晶,然后用水浴加热烘干就可得到CuSO4?5H2O晶体,注意温度不能过高,防止晶体分解,
故答案为:冷却结晶;防止CuSO4?5H2O晶体分解;
(4)加入FeCl3和CuSO4溶液,二者阴离子不同,不能排除阴离子的干扰,
故答案为:错误;根据控制变量的思想,所用溶液的阴离子不同,无法比较阳离子的催化效率.
本题解析:
本题难度:一般
3、选择题 实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+ H2SO4,由该反应可以推测
[? ]
A. CuS易水解
B. CuS可溶于盐酸
C. 相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D. 强酸可以制取弱酸
参考答案:C
本题解析:
本题难度:简单
4、填空题  与足量的稀硝酸完全反应,求:
与足量的稀硝酸完全反应,求:
(1)写出铜与稀硝酸反应的化学方程式____________________________________________ 。
(2)反应后生成硝酸铜的物质的量__________________ ;
(3)参加反应的稀硝酸的物质的量________________________ ;
(4)标准状况下,生成NO气体的体积__________________;?
(5)被还原硝酸的物质的量____________________ 。
参考答案:(1)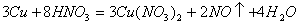
(2)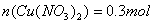
(3)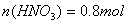
(4)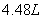
(5)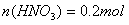
本题解析:
本题难度:一般
5、选择题 下列有关金属的说法中,不正确的是
[? ]
A.钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来
B.镁燃烧发出耀眼的白光,常用于制造信号弹和焰火
C.铜能与氯化铁溶液反应,该反应可应用于印刷电路板的制作
D.铁能与硫酸发生反应,不能用铁制容器贮存浓硫酸
参考答案:D
本题解析:
本题难度:一般