| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《弱电解质电离平衡》考点巩固(2017年最新版)(六)
参考答案:B 本题解析:用水稀释0.1 mol·L-1的CH3COOH溶液,醋酸的电离平衡破坏,平衡正向移动,氢离子的物质的量增大,但是浓度减小,相应的氢氧根离子浓度增大,因此选B。 本题难度:一般 3、填空题 A、B、C、D、E五种溶液分别是NaOH、NH3?H2O、CH3COOH、HCl、NH4HSO4中一种.常温下进行下列实验:
③c(H+)和c(OH-)的乘积④OH-的物质的量 (3)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的______曲线(填写序号). (4)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______(填写序号) ①反应所需要的时间E>A ②开始反应时的速率A>E ③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A ⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余 (5)室温下,向0.01mol?L-1C溶液中滴加0.01mol?L-1D溶液至中性得到的溶液中所有离子的物质的量浓度大小关系为______. 参考答案:(1)中和酸性物质A只有NaOH、NH3?H2O,物质的量的A与等物质的量浓度B和D混合呈中性,D的用量少,说明D碱性比B的碱性强,所以D是NaOH,故答案为:NaOH; 本题解析: 本题难度:简单 4、选择题 关于溶液的酸性、酸性强弱的说法中,正确的是 |
参考答案:B
本题解析:溶液的酸碱性主要由c(H+)和c(OH-)的相对大小决定,若c(H+)>c(OH-)溶液显酸性;若c(H+)<c(OH-)溶液显碱性;若c(H+)=c(OH-)溶液显中性。溶液的酸性只与溶液中c(H+)的相对大小有关,而与强酸及弱酸无关,因此答案是B。
本题难度:一般
5、选择题 在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH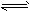 CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
[? ]
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《键参数——.. | |