微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (6分)若定义某物质的转化率为消耗掉的该物质的物质的量占起始时该物质的原物质的量的百分比。已知合成氨反应为N2(g) + 3H2(g)  ?2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
?2NH3(g).在一体积为10L且容积不变的密闭容器中放入1mol N2和3mol H2 ,在一定条件下发生反应,经4min达到化学平衡状态,测得容器中氨气的物质的量为0.6mol.。求:
(1)氮气的转化率
(2)用氢气表示平均反应速率是多少?
(3)平衡状态时氢气的物质的量浓度。
参考答案:
(1)30%?(2)0.0225 mol·(L·min)-1?(3)0.21 mol·L-
本题解析:略
本题难度:简单
2、填空题 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2溶液、NaOH溶液、盐酸.按要求回答:
(1) 电工操作上规定不能把铜导线和铝导线连接在一起使用.说明原因? .
(2)若电极材料选铜和石墨,电解质溶液选硫酸铜溶液,外加导线,能否构成原电池??,若能,请写出电极反应式,负极?,正极 ??.(若不能,后面两空不填)
(3)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化为电能,在燃料电池中,可燃物在 ??极反应, ?在另一极反应。
参考答案:(1)铜铝接触在潮湿的环境中形成原电池反应,加快了铝腐蚀的速率,易造成电路断路。(2)能、负极反应式为2Cu-4e-=2Cu2+;正极反应式为O2+4H++4e-=2H2O (3)负、助燃物
本题解析:(2)铜虽然是活泼性弱的金属,但不是惰性电极,铜与石墨导线连接在盐溶液中可以构成原电池装置,铜作负极。正极反应是溶解在溶液中的氧气得电子,酸性溶液中的电极反应为:O2+4H++4e-=2H2O,中性或弱碱性溶液中的电极反应式为:O2+2H2O+4e-=4OH-。
本题难度:简单
3、选择题 如图所示,将铁棒和石墨棒插入l L l mol·L-1食盐水中。下列说法正确的是
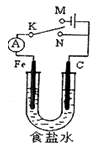
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH-—4e-=2H2O+O2↑
C.若电键K与M连接,若在溶液中滴入酚酞试液,则在石墨棒附近先出现红色
D.若电键K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
参考答案:D
本题解析:A 错误,若电键K与N连接,铁、碳形成原电池,铁做负极,容易腐蚀
B 错误,正极反应为吸氧腐蚀,O2+4e-+2H2O=4OH-
C 错误,若电键K与M连接,铁做阴极,若在溶液中滴入酚酞试液,则在铁棒附近先出现红色
D 正确。
本题难度:一般
4、选择题 下列关于原电池和电解池的说法正确的是( )
A.

如图所示,把盐桥换为铜导线也可以形成原电池
B.电解饱和食盐水制烧碱,用碳钢网作阳极
C.白铁是在铁上电镀锌,用锌作阳极,铁作阴极
D.电解法精炼粗铜时,电解质溶液CuSO4溶液浓度不变
参考答案:A、把盐桥换为铜导线,硫酸铜溶液的烧杯中无氧化还原反应,硫酸亚铁溶液的烧杯中无自发进行的氧化还原反应,不能形成原电池,故A错误;
B、电解饱和食盐水制烧碱,用碳钢网作阳极,铁失电子生成亚铁离子结合阴极附近氢氧根形成沉淀,不能制的氢氧化钠,故B错误;
C、镀原理是镀层金属做阳极,待镀金属做阴极;白铁是在铁上电镀锌,用锌作阳极,铁作阴极,故C正确;
D、电解法精炼粗铜时,阳极失电子的除铜外,铁、镍、锌等也失电子,电解质溶液CuSO4溶液浓度发生改变,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 氢氧燃料电池可同时供应电和水蒸气,所用燃料为H2,电解质为熔融的K2CO3。已知该电池的正极反应为:O2+2CO2+4e-=2C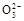 。下列叙述正确的是(?)
。下列叙述正确的是(?)
A.放电时C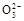 向正极移动
向正极移动
B.放电时OH-向负极移动
C.负极反应为H2+C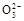 -2e-=H2O+CO2
-2e-=H2O+CO2
D.当该电池产生的水蒸气折算成标准状况下的体积为22.4 L时,转移电子4 mol
参考答案:C
本题解析:原电池中阴离子向负极移动,A错;熔融的K2CO3中没有OH-,B错;C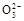 是电池内的导电微粒,该电池的总反应为2H2+O2=2H2O,用总反应式-正极反应式=负极反应式,C正确;生成1 mol水,转移电子2 mol,D错。
是电池内的导电微粒,该电池的总反应为2H2+O2=2H2O,用总反应式-正极反应式=负极反应式,C正确;生成1 mol水,转移电子2 mol,D错。
本题难度:一般