微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
n(SO32-)∶n(HSO3-)
| 91∶9
| 1∶1
| 9∶91
|
pH
| 8.2
| 7.2
| 6.2
|
?
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
参考答案:(1)SO2+H2O?H2SO3、2H2SO3+O2 2H2SO4
2H2SO4
(2)2OH-+SO2=H2O+SO32-
(3)①酸 HSO3-存在:HSO3- H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O H2SO3+OH-,HSO的电离程度大于水解程度
H2SO3+OH-,HSO的电离程度大于水解程度
②ab
(4)C
本题解析:(1)二氧化硫形成硫酸型酸雨的过程为二氧化硫与水反应生成亚硫酸,亚硫酸再被氧化成硫酸。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①由表格数据知,随n(HSO3-)的增大,溶液酸性增强,即HSO3-的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
(4)H2SO4溶液显酸性、氯水具有漂白作用,A、B均不能证明平衡移动了;加入BaCl2溶液后,平衡发生移动。
本题难度:一般
2、实验题 (12分)根据下图回答问题:
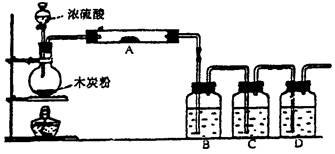
(1)写出浓H2SO4和木炭粉在加热条件下反应的化学方程式?。
(2)若用图中的装置检验上述反应的全部产物,完成下列各题:
A中加入的试剂是?,作用是?
B中加入的试剂是?,作用是?
C中加入的试剂是?,作用是?
D中加入的试剂是?,作用是?
(3)实验时,C中应观察到的现象是:?
参考答案:(1)2H2SO4(浓)+C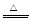 2H2O+CO2↑+2SO2↑(2分)
2H2O+CO2↑+2SO2↑(2分)
(2)A无水硫酸铜?检验H2O?
B品红溶液?检验SO2?
C酸性KMnO4溶液?吸收SO2?
D澄清石灰水?检验CO2?(每空1分)
(3)酸性高锰酸钾溶液的颜色不褪尽(或不褪色,或不褪成无色)(2分)
本题解析:(2)首先明确实验目的:检验上述反应的产物(H2O、CO2、SO2);
然后确定检验时所需试剂:通常H2O用无水CuSO4白色粉末检验(因两者反应会生成蓝色晶体:CuSO4·5H2O);CO2用澄清石灰水检验(因两者反应会生成CaCO3白色沉淀),SO2用品红溶液检验(因SO2有漂白性,能使品红褪色),
其次,明确三者的检验顺序:应先检验H2O(因检验CO2、SO2时都要用到水溶液,会带入水蒸气,则干扰产物中水的检验),再检验SO2(因SO2也能澄清石灰水变浑浊,故在检验CO2前排除SO2),最后检验CO2;
所以:A中盛放无水CuSO4白色粉末,作用:检验产物水,现象:变蓝
B中盛放品红溶液,作用:检验SO2,现象:褪色
C中盛放酸性KMnO4,作用:利用氧化还原反应除去SO2
D中盛放澄清石灰水,作用:检验CO2,现象:出现白色浑浊
(3)因SO2会干扰CO2的检验,故在C中要除尽SO2,则要求有足量的酸性KMnO4溶液,故现象为:酸性高锰酸钾溶液的颜色不褪尽(或不褪色,或不褪成无色)
本题难度:一般
3、选择题 下列物质中,属于同素异形体的是
A.S2和S4
B.CO和CO2
C. 和
和
D.H2和D2
参考答案:A
本题解析:同素异形体是指同种元素形成的不同单质之间互称为同素异形体。A、符合同素异形体的定义,正确;B、不是单质,错误;C、不是单质,是同位素关系,错误;D、H2和D2是由不同氢原子构成的双原子分子,不是同素异形体,错误,答案选A。
本题难度:一般
4、选择题 下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将硫酸滴入装有亚硫酸钠固体的培养皿中。
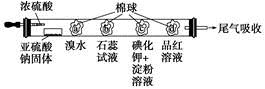
关于此实验的“现象”、“解释或结论”以及对应关系均正确的是
选项
| 现象
| 解释或结论
|
A
| a处黄色褪去
| 非金属性:Br>S
|
B
| b处变为红色
| 二氧化硫与水反应生成酸性物质
|
C
| c处变为蓝色
| 二氧化硫具有一定的氧化性
|
D
| d处红色先褪去后恢复
| 二氧化硫具有漂白性且漂白性不稳定
|
?
参考答案:B
本题解析:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O。a处反应为SO2+Br2+H2O=H2SO4+2HBr,证明SO2的还原性大于Br-,而不是非金属性Br>S,A错误;b处反应为SO2+H2O H2SO3
H2SO3 H++
H++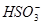 ,显酸性,B正确;I2能氧化SO2,SO2不能氧化I-,C处不变蓝,C错误;d处红色褪去,加热后才会恢复红色,证明SO2的漂白性不稳定,D错误。
,显酸性,B正确;I2能氧化SO2,SO2不能氧化I-,C处不变蓝,C错误;d处红色褪去,加热后才会恢复红色,证明SO2的漂白性不稳定,D错误。
本题难度:一般
5、选择题 北京市为了降低燃煤产生SO2的排放量,采取了许多有力的措施。措施之一是推广使用低硫煤,并向煤中加入石灰石,该方法可减少SO2的排放,此法称为“钙基固硫”。这种煤燃烧后,大部分硫元素最终存在形式为
A.CaSO4
B.CaSO3
C.CaS
D.SO3
参考答案:A
本题解析:钙基固硫过程中发生的反应:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4,所以硫元素主要以CaSO4形式存在。答案选A。2的性质
点评:本题比较基础,难度较小。
本题难度:简单