微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是

A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO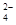 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:BC
本题解析:A、处于曲线上的点为饱和溶液的平衡状态,故A正确;B、a、c两点温度相同,Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,故B不正确;C、根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO4-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO4-)小于3×l0-3mol/L,故C不正确;D、d点为不饱和状态,钙离子浓度较小,如加入适量CaCl2固体,钙离子浓度增大,此时硫酸根离子浓度不变,则可以变到c点,故D正确,故选BC。
本题难度:一般
2、选择题 下表列出了几种常见物质的电离常数或溶度积:

在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是(? )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
参考答案:C
本题解析:加入等体积的溶液后,CaCl2溶液被稀释。现分别计算如下:A溶液中c(OH-)=10-9 mol/L,则c(H+)=10-5 mol/L,而c(F-)≈c(H+)=10-5 mol/L,混合后,c(F-)<10-5 mol/L,即便是按10-5 mol/L计算,(10-5)2×0.1也小于1.5×10-10,因而无沉淀生成。B中也无沉淀生成,计算方法同上。C中c(HCO3-)≈0.5 mol/L,由于溶液呈碱性,则c(H+)<10-7 mol/L,再根据Ka,估算c(CO32-)>2.8×10-4 mol/L。而c(Ca2+)·c(CO32-)>0.1×2.8×10-4>2.8×10-9,因而有沉淀生成。同样可分析知D中无沉淀生成。
本题难度:简单
3、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
参考答案:
本题解析:
本题难度:困难
4、填空题 乙二胺四乙酸(EDTA)及其盐是常用于定量检测和分析金属离子的重要试剂。EDTA的阴离子可简写为Y4-,它与一些金属离子反应生成稳定的金属有机化合物离子:M2++Y-=(MY)2-;M3++Y4-=(MY)-。两反应的平衡常数分别记作K[(MY)2-] 和K[(MY)-] 已知:Zn2+遇二甲酚橙显红色,且Zn(CH3COO)2易电离试根据上述信息,回答下列问题。
(1)(MY)x-的结构简式如下图,该离子中与金属离子相连接的有6个共价键,则该离子结构中共含有____个五元环。
(2)现称取某铝盐试样0.2500g,将其溶于水后加入0.05000 mol/L EDTA溶液25.00mL,在适当条件下充分反应后,调节溶液的pH为5~6,加入指示剂二甲酚橙,再用0.02000 mol/L的Zn(CH3COO)2溶液25.00mL 滴定至终点,
问:达到终点的标志是_________________________;求该试样中铝元素的质量分数______________。
(3)有一起始含0.01 mol/L的M2+、0.5 mol/LEDTA(Y4-)和0.001 mol/L的S2-的溶液,判断在该溶液中能否产生金属硫化物(MS)沉淀。?
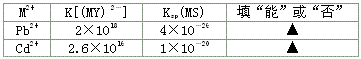
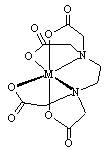
参考答案:(1)5
(2)溶液由无色变为红色,且半分钟内不褪色;8.100%?
(3)能;不能
本题解析:
本题难度:一般
5、选择题 常温下,CaSO4在水中的沉淀溶解平衡曲线如下图所示,Ksp(CaSO4)= 9.0×10-6。下列说法中正确的是

[? ]
A.通过蒸发可以使溶液由d点变到c点
B.a点对应的Ksp等于c点对应的Ksp
C.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
参考答案:B
本题解析:
本题难度:一般