| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》在线测试(2017年最新版)(六)
参考答案:B 本题解析:标准状况下11.2L氢气的物质的量为:11.2L/22.4L/mo l=0.5mol,假设金属都为+2价,根据电子转移守恒可知,金属的物质的量为0.5mol,则金属混合物的平均摩尔质量为:26g/0.5mo l=52g/mol,A.Fe的相对原子质量为56,Zn的相对原子质量为65,二者的平均摩尔质量一定大于52g/mol,错误;B.当Al的化合价为+2价时,可看成其相对原子质量为:2/3×27=18,Zn的相对原子质量为65,二者的平均摩尔质量可以为52g/mol,正确;C.Mg的相对原子质量为24,Al的化合价为+2价时,可看成其相对原子质量为:2/3×27=18,二者的平均摩尔质量一定小于52g/mol,错误;D.Fe的摩尔质量为56g/mol>52g/mol,铜不与稀硫酸反应,26g金属混合物与稀硫酸反应生成的氢气一定小于0.5mol,错误; 本题难度:一般 3、计算题 现有50mL密度为1.18g/mL、质量分数为36.5%的浓盐酸:求 参考答案:(1)质量分数和物质的量浓度的关系为 本题解析:考查物质的量浓度的有关计算。质量分数和物质的量浓度都可以用来表示溶液的组成,它们之间的关系为 本题难度:一般 4、实验题 (8分)用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有: |
参考答案:(1)5.4 (2)A、C (3)①④(4)B、D
本题解析:(1)设需要浓硫酸体积为VmL,根据溶质物质的量相等可得:0.1×1=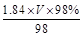 ,V=5.4。
,V=5.4。
(2)实验时需要的仪器有:量筒(10mL)、玻璃棒、烧杯、100mL容量瓶、胶头滴管。
(3)定容时俯视,V偏小,c偏大;容量瓶未干燥,对所配溶液浓度无影响;定容后发现液面低于刻度结,再加水使V偏大,c偏小;浓硫酸在烧杯中稀释后未冷却使V偏小,c偏大。
(4)容量瓶使用前要检查是否漏水,容量瓶用蒸馏水洗净后不能用待配液润洗,否则会使所配溶液浓度偏高,不能直接在容量瓶中配制溶液,应先在烧杯中溶解、冷却至室温后,再将烧杯中溶液转移入容量瓶。
考点:一定物质的量浓度溶液的配制
点评:分析误差时根据公式c=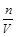 ,分析n、V的变化。
,分析n、V的变化。
本题难度:一般
5、选择题 20℃时,饱和KCl溶液的密度为1.174 g/cm3,物质的量浓度为4.0mol/L,则下列说法中不正确的是
[? ]
A.25℃时,饱和KCl溶液的浓度大于4.0 moI/L
B.此溶液中KCl的质量分数为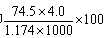 %
%
C.20℃时,密度小于1.174 g/cm3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到20℃时,溶液的密度一定大于1.174 g/cm3
参考答案:D
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《难溶电解质.. | |