微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (22分)草木灰中富含钾盐,主要成分是碳酸钾,还含有少量氯化钾、硫酸钾。现从草木灰中提取钾盐,并用实验检验其中的 CO32—、 SO42—和 Cl—。
(1)从草木灰中提取钾盐的实验操作顺序如下:①称取样品,②溶解,③?,④?,⑤冷却结晶。
(2)将制得的少量晶体放入试管,加入蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有?生成,证明溶液中有?离子。
②在第二支试管里加入足量稀盐酸后,再加入?,可观察到有?生成,证明溶液中有?离子;写出相关的化学方程式??;
判断所加入稀盐酸已经足量的方法是_____________?_________?_。
③在第三支试管里加适量的硝酸银,观察到有沉淀产生,由此证明溶液中一定含Cl—、。你认为该结论是否严密?为什么?
?。
参考答案:(22分)(1)②过滤,取滤液;(2分) ③蒸发滤液(2分)
(2)有气泡产生;(2分)CO32-(2分)
②氯化钡溶液;(2分)白色沉淀;(2分) SO42-(2分)
2HCl+K2CO3=2KCl+H2O+CO2↑ (2分) K2SO4+BaCl2=2KCl+BaSO4↓;(2分)
继续滴入稀盐酸,溶液中不再产生气体(2分)
③不严密;碳酸根、硫酸根也会与银离子作用产生沉淀。(2分)
本题解析:(1)草木灰中含有不溶性杂质,所以溶解后应该是过滤;然后将滤液蒸发结晶即可。
(2)①碳酸盐能和盐酸反应生成CO2,所以如果出现气泡,则说明含有CO32-;
②检验SO42-的方法是先加入盐酸,然后再加入氯化钡溶液,观察产生的白色沉淀即可;先加入盐酸,首先和溶液中的碳酸钾反应,方程式是2HCl+K2CO3=2KCl+H2O+CO2↑;而氯化钡与硫酸钾反应的方程式是K2SO4+BaCl2=2KCl+BaSO4↓;判断盐酸是否过滤的方法是继续加入盐酸,即继续滴入稀盐酸,溶液中不再产生气体,就说明盐酸已知过量。
(3)由于碳酸根离子、硫酸根离子也会与银离子作用产生白色沉淀,所以不能通过白色沉淀来说明含有氯离子。
本题难度:一般
2、选择题 下列实验中用错试剂的是
[? ]
A.用稀盐酸清洗做焰色反应的铂丝
B.用酒精萃取碘水中的碘
C.用稀硝酸清洗残留在试管壁上的铜
D.用饱和食盐水除去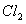 中的
中的
参考答案:B
本题解析:
本题难度:简单
3、选择题 二氧化碳中混有少量氯气和氯化氢杂质,为了除去杂质而获得较纯的二氧化碳气体,应选用的最好方法是?
A.通过NaOH溶液
B.通过饱和NaHCO3溶液
C.通过蒸馏水
D.通过CuSO4溶液
参考答案:B
本题解析:题中CO2和杂质Cl2、HCl都能与NaOH反应,故不能选用A为除杂质试剂。因NaHCO3与盐酸能发生反应生成NaCl、H2O和CO2,而氯气和氯化氢溶于水都能生成盐酸,并且CO2不能与NaHCO3反应,则选项B是,本题除杂质Cl2和HCl的最好方法。如果选用蒸馏水去吸收杂质气体Cl2和HCl,因HCl被吸收后使溶液性增强,这时Cl2的溶解度将变小,因此不易除尽,所以不能选择C。而CuSO4溶液既不能与Cl2反应,又不能与HCl反应则更不能选择D。
本题难度:一般
4、选择题 蛇纹石由MgO.A12O3.SiO2.Fe2O3组成。现取一份蛇纹石试样进行实验,首先将其溶于过量的盐酸,过滤后,在所得的沉淀X和溶液Y中分别加入NaOH溶液至过量。下列叙述错误的是 ?
A.沉淀X的成分是SiO2
B.将蛇纹石试样直接溶于过量的NaOH溶液后过滤,可得到红色颜料Fe2O3
C.在溶液Y中加入过量的NaOH溶液,过滤得到的沉淀的主要成分是Fe(OH)3和Mg(OH)2
D.溶液Y中的阳离子主要是Mg2+.Al3+.Fe3+.H+
参考答案:B
本题解析:A.MgO.A12O3.Fe2O3溶于过量的盐酸,沉淀X的成分是SiO2,正确;B.溶于过量的NaOH溶液,A12O3.SiO2溶于NaOH溶液,过滤,可得到Fe2O3和MgO,错误;C.Y:MgCl2.A1Cl3.
Fe Cl3,加入过量的NaOH溶液,得沉淀Fe(OH)3和Mg(OH)2,溶液是NaAlO2,正确;D.MgO.A12O3.
Fe2O3溶于过量HCl,阳离子主要是Mg2+.Al3+.Fe3+.H+,正确。
本题难度:一般
5、选择题 下列有关除杂的实验操作合理的是
[? ]
A.除去石英(主要成分为SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
B.除去甲苯中混有的少量苯酚:加入浓溴水后过滤
C.除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃
D.除去乙酸乙酯中混有的少量乙酸、乙醇:加人饱和氢氧化钠溶液振荡、静置后分液
参考答案:A
本题解析:
本题难度:一般