微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素X的气态氢化物的化学式为H2X,则X的最高氧化物的水化物的化学式为(?)
A.H2XO3
B.HXO3
C.H3XO4
D.H2XO4
参考答案:D
本题解析:H2X中X元素的化合价为—2,故其最高价为+6,最高氧化物的水化物的化学式H2XO4
本题难度:一般
2、填空题 V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族。Z的化合物可以发生某一反应,其离子方程式为:
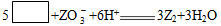 (未完成)。
(未完成)。
(1)Y、Z两种元素的简单离子的半径大小关系为 (用离子符号表示)。
(2)五种元素中分子的空间构型相同的氢化物沸点高低排列顺序为
(用分子式表示),其原因是 。
(3)V与Z单质不能直接化合生成VZ4,在催化剂作用下由VY2与Z2反应制得VZ4,其化学反应方程式为VY2+Z2→VZ4+Y2Z2(未配平)。
①写出上述化学反应方程式 。
②Y2Z2分子中,Y与Z均满足8e-结构,则Y2Z2的结构式为 。
③Y与W两种元素形成一种重要化合物A,A分子的结构如图所示:

6mol Y2Z2与16mol W的简单氢化物恰好完全反应生成A、Y单质和一种中学化学中常见的盐。写出该反应的化学方程式: 。
参考答案:(共10分)
(1)r(S2-)>r(Cl-)(1分)
(2)H2O>H2S(1分) H2O分子间存在氢键(2分)
(3)①CS2+3Cl2 CCl4+S2Cl2(2分) ②Cl―S―S―Cl(2分)
CCl4+S2Cl2(2分) ②Cl―S―S―Cl(2分)
③6S2Cl2+16NH3 S4N4↓+12NH4Cl+8S↓(2分)
S4N4↓+12NH4Cl+8S↓(2分)
本题解析:
由V、W、X、Y、Z五种短周期元素的原子序数依次增大,在周期表中W与V、X相邻,Y与Z相邻,X、Y同主族可知
V(C)
W(N)
X(O)
?
?
?
Y(S)
Z(Cl)
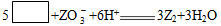 (未完成)。Z的最低负化合价是-1,说明Z是Cl ,Y是S ,X是O,W是N,V是C
(未完成)。Z的最低负化合价是-1,说明Z是Cl ,Y是S ,X是O,W是N,V是C
(1)r(S2-)>r(Cl-),电子层结构相同的阴离子原子序数小的半径大。
(2)H2O>H2S,由于水分子间存在氢键,是水的沸点升高。
(3)①CS2+3Cl2 CCl4+S2Cl2,氧化还原反应配平。
CCl4+S2Cl2,氧化还原反应配平。
?②Y2Z2分子中,Y与Z均满足8e-结构,共价键成建理论硫原子存在两个单电子,氯原子存在一个单电子,可知Cl―S―S―Cl
③6S2Cl2+16NH3 S4N4↓+12NH4Cl+8S↓氧化还原反应配平。
S4N4↓+12NH4Cl+8S↓氧化还原反应配平。
本题难度:一般
3、选择题 下列有关离子的检验中,结论正确的是
A.向某溶液中加入足量盐酸,产生无色无味气体,则该溶液中一定含有CO32-
B.向某溶液中加入足量氨水,产生白色沉淀,则该溶液中一定含有Al3+
C.向某溶液中加入足量盐酸,最终得到无色溶液,则该溶液中可能含有AlO2-
D.向某溶液中加入Na2CO3溶液,产生白色沉淀,则该溶液中一定含有Ca2
参考答案:C
本题解析:
本题难度:困难
4、选择题 据报道,某些建筑材料会产生放射性同位素222? 86Rn,从而对人体造成伤害,该同位素原子的中子数和质子数之差为?(?)
A.86
B.222
C.136
D.50
参考答案:D
本题解析:放射性同位素222? 86Rn,故该原子的相对原子质量为222,质量数为86,所以其中字数为222-86=136.所以该同位素原子的中子数和质子数之差为136-86=50,故本题的答案选择D。
点评:本题考查了同位素,属于对基础化学知识的考查,本题要掌握的是对于同位素222? 86Rn,左上标表示的是该原子的相对原子质量,而左下标表示的是其质子数,该题比较容易。
本题难度:简单
5、选择题 放射性核素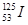 可用于治肿瘤,该核素中子数是(? )
可用于治肿瘤,该核素中子数是(? )
A.19
B.53
C.72
D.125
参考答案:C
本题解析:考查原子的组成及表示方法。在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以中子数是125-53=72,答案选C。
本题难度:简单