| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频试题特训(2017年最新版)(十)
参考答案:D 本题解析:因为这两个热化学方程式方向相反,所以,所求反应的△H为正值,且是484KJ/moL的一般,所以,△H=+242KJ/moL,选D。 本题难度:一般 2、选择题 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( ) |
参考答案:C
本题解析:碳完全燃烧放出的热量多,但放热越多,△H越小,所以①中ΔH前者小于后者;②中都是中和热,△H相等;消耗的氢气越多,放出的热量越多,同样放热越多,△H越小,所以③中ΔH前者大于后者;④中前者是吸热反应,后者是放热反应,ΔH前者大于后者,答案选C。
本题难度:一般
3、填空题 (1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的
2C(g)达到平衡时,各物质的
平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1。
若用a、b、c分别表示A2、B2、C的初始浓度(mol·L-1),则:
①a、b应满足的关系式是 。
②a的取值范围是 。
(2)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,肼(N2H4)可
作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)="===" N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4(1)+O2(g)="===" N2(g)+2H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式 ;
参考答案:(1)①a=b+0.4 ②0.4<a<1.3
(2) 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g) △H=-1048.9kJ/mol(3分)
本题解析:(1)一定条件下,可逆反应:A2(g)+B2(g)  2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="===" N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
2C(g)达到平衡时,各物质的平衡浓度分别为:c(A2)=0.5 mol·L-1;c(B2)=0.1 mol·L-1;c(C)=1.6 mol·L-1,若B2(g)完全反应,则a为0.4,即b为0,若C全部全部转化为A2(g)+B2(g),则a为1.3,b为0.9,所以①a、b应满足的关系式是a=b+0.4,而上述是假设状态,故a的取值范围是0.4<a<1.3;(2)肼和N2O4反应的热化学方程式可以由②N2H4(1)+O2(g)="===" N2(g)+2H2O(g)乘以2,再减去①N2(g)+2O2(g)="===" N2O4得到,故肼和N2O4反应的热化学方程式为 2N2H4(L)+N2O4(L)====3N2(g)+4H2O(g△H=-1048.9kJ/mol,(△H=-534.2×2+19.5=-1048.9kJ/mol)。
考点:化学平衡的计算、热化学方程式的书写
点评:本题考查了化学平衡的计算、热化学方程式的书写,该考点是高考考查的热点,本题有利于培养学生对化学平衡计算的理解能力,该难度中等。
本题难度:一般
4、选择题 已知:25℃、101kPa时,
(1)12g石墨不完全燃烧生成CO,放出110.5kJ热量,CO继续燃烧又放出283.0kJ热量;
(2)金刚石燃烧的热化学方程式为:C(金刚石,s)+O2(g)==CO2(g);ΔH=-395.0kJ·mol-1。
下列说法中正确的是
[? ]
A.由石墨制备金刚石是放热反应
B.等质量时,金刚石所具有的能量比石墨所具有的能量低
C.CO燃烧的热化学方程式为:2CO(g)+O2(g)===2CO2(g);ΔH=-283.0kJ·mol-1
D.石墨燃烧的热化学方程式为:C(石墨,s)+O2(g)===CO2(g);ΔH=-393.5kJ·mol-1
参考答案:D
本题解析:
本题难度:一般
5、填空题 研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2 (g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。

③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
参考答案:(1)5CO(g)+I2O5(s)=5CO2(g)+I2(s) △H=-1377.22kJ/mol
(2)b 2.67或8/3 (3)①< ②不 ③CH3OH-6e-+H2O=6H++CO2
本题解析:(1)根据反应①2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1、②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1并依据盖斯定律可知,(②×5-①)÷2即得到反应5CO(g)+I2O5(s)=5CO2(g)+I2(s),所以该反应的反应热△H=(-566.0 kJ/mol×5+75.56 kJ/mol)÷2=-1377.22kJ/mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。该反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;颜色深浅和浓度有关系,随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;根据方程式可知,每消耗1molSO2的同时一定生成1molNO ,即d中所述的两个速率方向相同,不能作为平衡状态的判断依据,所以正确的答案选b。反应前后体积不变,因此可以用物质的量表示浓度计算平衡常数,则
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) n 2n 0 0
转化量(mol) x x x x
平衡量(mol) n-x 2n-x x x
则根据平衡时NO2与SO2体积比为1∶6可知6×(n-x)=2n-x
解得x=0.8n
所以该反应的平衡常数K=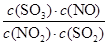 =
=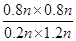 =
=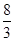
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡向吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0。
②根据图像可知,平衡时甲醇的浓度是0.75mol/L,则根据反应方程式CO2 (g)+3H2(g) CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=
CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=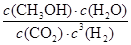 =
= =
=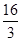 。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为
。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为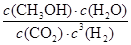 =
= =
=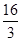 ,所以此平衡将不移动。
,所以此平衡将不移动。
③原电池中正极得到电子,发生还原反应,因此氧气在正极通入,氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O。负极失去电子,发生氧化反应,因此甲醇在负极通入,电极反应式为CH3OH-6e-+H2O=6H++CO2。
考点:考查反应热的计算、平衡状态的判断、平衡常数计算和应用、外界条件对平衡状态的影响以及电极反应式的书写等
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《物质的组成.. | |