微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下金属冶炼方法错误的是:
A.3MnO2 + 4Al 3Mn + 2Al2O3
3Mn + 2Al2O3
B.2AlCl3(熔融)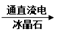 2Al + 3Cl2
2Al + 3Cl2
C.Fe2O3 + 3CO 2Fe + 3CO2
2Fe + 3CO2
D.2HgO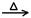 2Hg+ O2↑
2Hg+ O2↑
参考答案:B
本题解析:氯化铝是分子晶体,熔化时不导电,工业上是电解熔融的氧化铝来制备,B错误;
本题难度:一般
2、填空题 (共12分)钛是21世纪金属。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
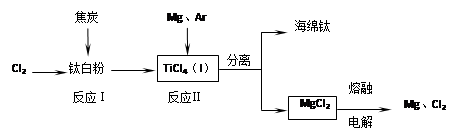
已知:① Mg(s)+Cl2 (g)=MgCl2 (s)? △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l)? △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为?。
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为?;
反应II的热化学方程式为?。
(3)该工艺流程中,可以循环使用的物质有?(填化学式)。
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的?极,阴极的电极反应式为?。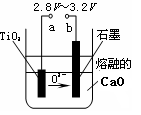
参考答案:(共12分)每空2分(1)TiO2++2H2O=H2TiO3↓+2H+(2分)
(2)TiO2+2Cl2+2C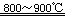
2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s)? △H=-512 kJ·mol-1(2分,状态不写0分)
(3)Mg、Cl2(每空1分,共2分)
(4)正(2分)? TiO2+4e-=Ti+2O2-(2分)
本题解析:(1)TiO2+发生水解生成钛酸(H2TiO3)沉淀,说明水解程度很大,所以TiO2+发生水解的离子方程式为TiO2++2H2O=H2TiO3↓+2H+。
(2)根据元素的组成可知,可燃性无色气体应该是CO,所以该反应的化学方程式是TiO2+2Cl2+2C?TiCl4+2CO。根据盖斯定律可知,(①-②)×2即得到2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s),所以该反应的反应热△H=(-641kJ/mol+385 kJ/mol)×2=-512 kJ/mol。
(3)根据转化图可知,最后氯化镁电解又生成镁和氯气,二者可以循环使用。
(4)根据装置图可知,氧离子向b电极移动,所以与b相连的电极是阳极,因此b是电源的正极。电解池中阴极是得到电子的,所以阴极电极反应式是TiO2+4e-=Ti+2O2-。
点评:本题难度不是很大,考查的知识点较多、综合性较强,考查同学们新信息获取、处理及灵活运用所学知识(化学方程式、电极反应式的书写、盖斯定律以及电源正负极的判断等)进行分析问题、解决问题的能力。重点考查学生对化学知识的熟练掌握程度,以及灵活运用知识解决实际问题的能力。
本题难度:一般
3、选择题 下列化学反应在金属冶炼工业中还没有得到应用的是:
A.2NaCl(熔融)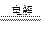 2Na + Cl2↑
2Na + Cl2↑
B.Al2O3 +3C ="====" 2Al + 3CO↑
C.Fe2O3 + 3CO 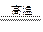 2Fe + 3CO2↑
2Fe + 3CO2↑
D.2Ag2O
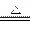 4Ag + O2↑
4Ag + O2↑
参考答案:B
本题解析:略
本题难度:一般
4、填空题 工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。
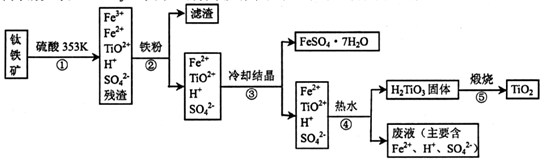
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异? b溶解性差异? c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为?
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
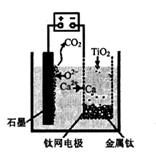
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
参考答案:
(1) 2Fe3++Fe=3Fe2+? (2分)?(2) b? (2分)?(3) 过滤? (2分)
(4) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O? (2分)
(5)① 2O2-—4e-+C=CO2↑? (2分)?
② 制备TiO2时,电解槽发生反应:2CaO 2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
(6) 24%? (2分)
本题解析:(1)见答案(2)将FeSO4·7H2O从溶液中分离出来,利用了物质溶解性的差异(3)步骤②、③、④均是固液分离(4)废液中含有H+和Fe2+具有还原性,与MnO2发生氧化还原反应(5)由图可知,O2-在阳极放电,石墨电极参与反应生成了CO2
(6)Ti?~? TiO2
48? 80
m= 0.96t? 1.6t
则钛铁矿中钛元素的质量分数是0.96÷4.0×100%=24%
本题难度:一般
5、选择题 汽车用乙醇汽油是把变性燃料乙醇和汽油按一定比例混配形成的一种新型汽车燃料。经多项检测结果表明,它不影响汽车的行驶性能,还可以减少有害气体的排放量。在美国、巴西等国早已推广使用。下列有关乙醇汽油的说法正确的是
A.乙醇汽油是一种纯净物
B.乙醇汽油作燃料不会产生碳氧化物等有害气体,其优点是可以减少对环境的污染
C.乙醇和汽油都可作溶剂,也可相互溶解
D.乙醇和乙二醇互为同系物
参考答案:C
本题解析:乙醇汽油属于混合物,A不正确;B不正确,乙醇汽油燃烧生成CO2,也有可能燃烧生成CO,B不正确;乙二醇中含有2个羟基,和乙醇不可能互为同系物,D不正确,答案选C。
点评:该题是基础性试题的考查,试题基础性强,侧重对基础知识的检验和训练,有利于培养学生学习兴趣和学习积极性,也有助于培养学生的环境保护意识和能源节约意识。
本题难度:简单