微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (17分)化学反应原理在科研和生产中有广泛应用。
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。

①该反应的△H??0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略
2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
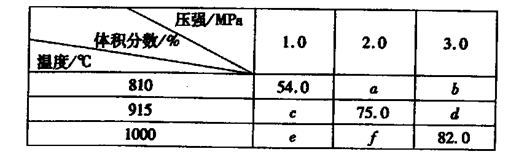
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为?,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 ?HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=?,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
?HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh=?,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  ?HCO3-+OH-的事实?。
?HCO3-+OH-的事实?。
参考答案:(1)①>。②R。(2)大于;f>a>b;69.5%。(3)2.5×10—8,取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
本题解析:(1)①根据图(1)知,该反应的K正随温度的升高而增大,则该反应正向为吸热反应,△H>0。②根据图(2)知,该反应的化学方程式为2W+Q→3N+P+2R;某温度下,平衡常数表达式为K =c2(X),根据平衡常数表达式的书写原则:固体或纯液体不写入平衡常数表达式,则由图(2)判定X代表的物质为R。
(2)反应:E(g)+F(s) 2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s)
2G(g)正向为气体体积减小的反应,加压,平衡逆向移动,G的体积分数(%)减小,结合题给数据分析,横行为压强对平衡影响的数据,即54.0>a>b;c>75.0>d;e>f>82.0;可得a、b、f三者的大小关系为f>a>b。根据上述分析知,e>c>54.0,表中数据纵行为温度对平衡的影响,升温,G的体积分数(%)增大,平衡正向移动,则该反应正向为吸热反应,则K(915℃)与K(810℃)的关系为K(915℃)大于K(810℃)。根据题给数据知,1000℃、3.0 MPa时G的体积分数(%)为82.0,根据反应:E(g)+F(s) 2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。
2G(g)利用三行式计算,设起始加入的E物质的量为1mol,转化的为x。
E(g)+F(s) 2G(g)
2G(g)
起始(mol):1?足量? 0
转化(mol):x? 2x
平衡(mol):1—x? 2x
则2x/1+x=82.0%,解得x=0.695,E的转化率为69.5%。
(3)25℃时,H2CO3电离常数Ka=c(HCO3—)c(H+)/c(H2CO3),NaHCO3的水解常数Kh=c(H2CO3)c(OH-)/c(HCO3—),则Ka·Kh=Kw,Kh=Kw/Ka=10—14/4×10—7=2.5×10—8,证明Na2CO3溶液中存在
 CO32-+H2O? HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
CO32-+H2O? HCO3-+OH-的事实为取少量碳酸钠溶液置于试管中,滴加氯化钡溶液有白色沉淀生成,证明含有碳酸根;另取少量碳酸钠溶液置于试管中,滴加酚酞溶液变红,证明有氢氧根生成。
本题难度:一般
2、填空题 (8分)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(按照要求用 a、 b 、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是______________。
(3)当三种酸物质的量浓度相同时,三种溶液中水的电离程度由大到小的顺序是________________。
(4)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________________。
(5)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是____________。
(6)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是_________
(7)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是_________________。
参考答案:21、(1)b>a >c ; (2) b>a ="c" ;(3)c >a > b (4) c >a > b
(5)c >a = b (6)a =" b=" c a =" b" < c (7)c >a = b
本题解析:①氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c;
②同体积同物质的量浓度的三种酸,三种酸n(HCl)=n(CH3COOH)=n(H2SO4),盐酸和醋酸是一元酸,硫酸是二元酸,盐酸和醋酸需要氢氧化钠的物质的量相等,硫酸需要的氢氧化钠是盐酸和醋酸的2倍,中和NaOH能力由大到小的顺序是b>a=c;
③氯化氢和硫酸是强电解质,在水中完全电离,盐酸是一元酸,所以盐酸中c(H+)=c(HCl),硫酸是二元酸,硫酸溶液中c(H+)=2c(H2SO4),醋酸是一元弱酸,所以醋酸溶液中c(H+)<c(CH3COOH),所以等物质的量浓度的三种酸,氢离子浓度大小顺序是b>a>c,氢离子浓度越大,水的电离程度越小,三种溶液中水的电离程度由大到小的顺序是c >a > b;
④氯化氢和硫酸是强电解质,盐酸是一元酸,硫酸是二元酸,醋酸是弱电解质且是一元酸,所以盐酸中氢离子浓度与酸的浓度相等,硫酸中氢离子浓度是硫酸的浓度的2倍,醋酸中氢离子浓度小于醋酸的浓度,所以如果氢离子浓度相等时,物质的量浓度由大到小的顺序为c>a>b;
⑤氯化氢和硫酸是强电解质,完全电离,醋酸是弱电解质部分电离,当三者c(H+)相同时,醋酸的浓度大于盐酸,所以当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积醋酸最多,由大到小的顺序是c >a = b
⑥与锌反应时产生氢(气)的速率与氢离子浓度成正比,氢离子浓度越大,反应速率越大,当c(H+)相同、体积相同时,同时加入形状、质量、密度相同的锌,则开始时反应速率的大小关系是a=b=c,;随着反应的进行,弱酸继续电离,化学反应速率加快,若产生相同体积的H2,反应所需时间短,反应所需时间的长短关系是a =" b" < c;
⑦强酸溶液稀释100倍,氢离子浓度变为原来的1/100,,弱酸溶液稀释10倍,氢离子浓度变为大于原来的1/100,盐酸和硫酸是强酸,醋酸是弱酸,所以c(H+)由大到小的顺序为c>a=b。
考点:考查弱电解质的电离,化学反应速率,溶液的稀释,PH值等知识。
本题难度:一般
3、选择题 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH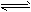 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
[? ]
A.加少量烧碱
B.降低温度
C.加少量冰醋酸
D.加水
参考答案:D
本题解析:
本题难度:一般
4、选择题 pH = 2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c = 0.1 mol/L)至pH = 7。消耗NaOH溶液的体积为Vx、Vy,则
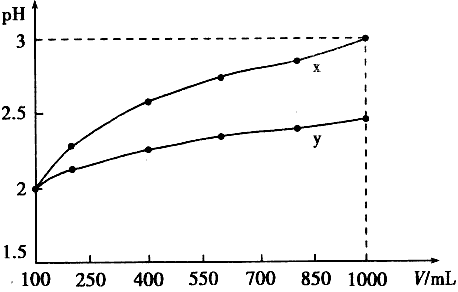
[? ]
A.x为弱酸,Vx<Vy?
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy?
D.y为强酸,Vx>Vy
参考答案:C
本题解析:
本题难度:一般
5、简答题 Ⅰ、现有25℃时,0.1mol?L-1的氨水,请回答下列问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中
______(填“增大”、“减小”或“不变”).
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,写出反应的离子方程式______,所得溶液的pH______7(填“>”、“<”或“=”).用离子方程式表示其原因______,所得溶液中各离子物质的量浓度由大到小的顺序是
______.
Ⅱ、现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32-.
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是(填编号)______.
(2)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是(填编号)______.
参考答案:Ⅰ、(1)若向氨水中加入少量硫酸铵固体,溶液中铵根离子浓度增大,抑制一水合氨电离,导溶液中导致溶液中氢氧根离子浓度减小,氨水分子浓度增大,c(OH-)c(NH3?H2O)减小,故答案为:减小;
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,二者反应生成硫酸铵和水,离子方程式为:NH3.H2O+H+=NH4++H2O,硫酸铵为强酸弱碱盐,铵根离子水解导致其溶液呈酸性,水解方程式为NH4++H2O?NH3.H2O+H+;
溶液中硫酸根离子不水解、铵根离子水解导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(NH4+)>c(SO42- ),盐溶液中水解程度较小,所以c(SO42- )>c(H+),则溶液中离子浓度大小顺序是:c(NH4+)>c(SO42- )>c(H+)>c(OH-);
故答案为:NH3.H2O+H+=NH4++H2O;<;NH4++H2O?NH3.H2O+H+;c(NH4+)>c(SO42- )>c(H+)>c(OH-);
Ⅱ、(1)①、②、③、④是盐,⑤是碱,PH值相同,碱的浓度最小,①、②、③、④四种盐的阳离子相同,其阴离子对应的酸越弱,酸根的水解程度越大,酸性:醋酸>碳酸>碳酸氢根>偏铝酸,PH值相同,酸根的水解程度越大,其物质的量浓度越小,故浓度④>②>①>③,即溶液体积④>②>①>③>⑤,
故答案为:④②①③⑤;
(2)碳酸根、碳酸氢根与铝离子发生彻底双水解反应生成氢氧化铝与二氧化碳,NaAlO2与氯化铝发生双水解反应生成氢氧化铝沉淀,CH3COONa与氯化铝不反应,NaOH与氯化铝反应生成氢氧化铝沉淀,
故答案为:③④⑤.
本题解析:
本题难度:简单