微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
[? ]
A.铝制容器可盛装热的浓H2SO4
B.AgI胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈
D.红磷在过量Cl2中燃烧生成PCl3
参考答案:C
本题解析:
本题难度:简单
2、选择题 铝能用来冶炼难熔金属(如Fe.V.Mn等),这是因为铝有
[? ]
A.两性
B.良好导电性
C.熔点低
D.还原性,在反应中放出大量热
参考答案:D
本题解析:
本题难度:简单
3、填空题 (1)已知氯气与水的反应Cl2+H2O?HCl+HClO是一个可逆反应,即不能进行到底的反应,且反应生成的次氯酸(HClO)是一种酸性比碳酸还要弱的酸.分别写出盐酸、次氯酸的电离方程式:______、______.
(2)镁带着火时,不能用液态CO2灭火剂来灭火的原因是(用化学方程式表示)______.
(3)将少量铁粉投入到过量稀硝酸中发生反应的离子方程式是______,在此反应中,硝酸体现了______性和______性.实验室中制取氨的化学方程式为______用______法收集.
参考答案:(1)盐酸是强电解质,次氯酸是弱电解质,电离方程式为:HCl═H++Cl-,HClO?H++ClO-,
故答案为:HCl═H++Cl-;HClO?H++ClO-,
(2)金属镁能在二氧化碳气体中燃烧:2Mg+CO2?点燃?.?C+2MgO,所以不能用液态CO2灭火剂来灭火,
故答案为:2Mg+CO2?点燃?.?C+2MgO;
(3)少量铁粉投入到过量稀硝酸中发生:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,离子方程式为:Fe+4H++NO3-=Fe3++2H2O+NO↑,在反应中硝酸中的氮元素部分化合价不变,生成硝酸盐,表现出硝酸的酸性,部分化合价降低,表现出硝酸的氧化性,则硝酸的作用为酸性和氧化性;?实验室用氯化铵固体与碱石灰固体共热来制取氨气,方程式为:
2NH4Cl+Ca(OH)2?△?.?CaCl2+2H2O+2NH3↑,氨气的密度小于空气,应采用向下排空气法,
故答案为:Fe+4H++NO3-=Fe3++2H2O+NO;酸;氧化性;?2NH4Cl+Ca(OH)2?△?.?CaCl2+2H2O+2NH3↑;向下排空气法;
本题解析:
本题难度:简单
4、实验题 设计实验探讨向AlCl3溶液中加入过量的NaOH和向NaOH溶液中加入过量的AlCl3现象是否一样。_________________________________
参考答案:向AlCl3溶液中逐滴加入NaOH有白色沉淀生成,当NaOH过量时沉淀溶解,最后生成物为NaAlO2。反应的离子方程式为:Al3++3OH-==Al(OH)3↓,Al(OH)3+OH-==?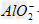 +2H2O
+2H2O
向NaOH溶液中逐滴加入AlCl3溶液时,观察到的现象是:开始有白色沉淀生成,振荡后立即消失,继续滴加AlCl3溶液直至过量时,又出现白色沉淀,且不消失。这是因为反应开始时,由于NaOH溶液过量,滴入的AlCl3和NaOH作用转化为NaAlO2,当加入过量AlCl3时,AlCl3和NaAlO2在溶液里发生反应,生成沉淀Al(OH)3。其反应的离子方程式为:Al3++3OH-====Al(OH)3↓,Al(OH)3+OH-==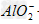 +2H2O,Al3++3
+2H2O,Al3++3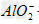 +6H2O==4Al(OH)3↓
+6H2O==4Al(OH)3↓
综上所述,二者滴加顺序不同,现象不一样。
本题解析:
本题难度:一般
5、选择题 向含1 mol HCl和l mol MgSO4?的混合溶液中加入1 mol/L的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)间的关系图正确的是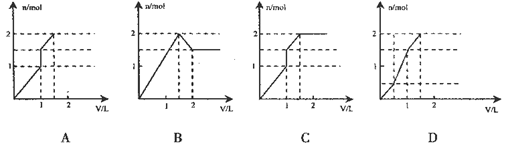
参考答案:D
本题解析:含1 mol HCl和l mol MgSO4?的混合溶液中加入1 mol/L的Ba(OH)2溶液,当加入1L时,溶液中的硫酸根离子全部转化为硫酸钡沉淀,同时HCL全部反应,同时还有氢氧化镁沉淀0.5mol,即当加入1LBa(OH)2溶液后生成沉淀为1.5mol,再加入Ba(OH)2溶液则镁离子继续反应生成氢氧化镁沉淀0.5mol,且最后沉淀质量不再变化;
综上所述,正确选项为D;
本题难度:一般