微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。
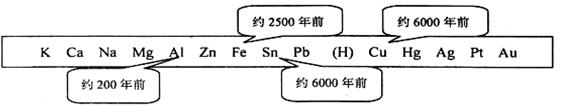
33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性? b. 金属元素在地壳中的含量
c. 金属的活动性顺序? d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
参考答案:33. c?(1分)?
34. Fe2O3+3CO 2Fe+3CO2?(1分)
2Fe+3CO2?(1分)
35. 相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。(合理即给分,1分)
铝表面形成致密的氧化膜,隔绝空气与内部的铝接触。?(1分)
36. AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH—?(2分)
Al3+ + 3OH—?(2分)
本题解析:33.金属大规模开发利用的先后顺序跟金属的活动性顺序有关。
34.高炉炼铁的原理Fe2O3+3CO 2Fe+3CO2。
2Fe+3CO2。
35.金属的活泼性可以与酸反应的速率来判断:相同形状大小的铝片和铁片放入相同浓度的盐酸中,观察气泡产生的速度,如铝片上产生气泡的速度快,说明铝比铁活泼。因铝表面有一层致密的氧化膜,故铝在空气中却表现出很强的抗氧化性。
36氢氧化铝的电离方程式是AlO2—+ H+ +H2O Al(OH)3
Al(OH)3 Al3+ + 3OH—。3的电离方程式。
Al3+ + 3OH—。3的电离方程式。
本题难度:一般
2、选择题 把a g铁铝合金粉末溶于足量盐酸中,加入过量的NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁与铝的物质的量之比为( )
A.9∶8
B.8∶9
C.1∶1
D.7∶3
参考答案:A
本题解析:略
本题难度:简单
3、选择题 若改变反应物的量,下列各组中的两物质相互反应时,产物并不改变的是
[? ]
A.NaAlO2和HCl
B.NaOH和CO2
C.Na2O2和CO2
D.AlCl3和NaOH
参考答案:C
本题解析:
本题难度:简单
4、选择题 下列物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
[?]
A.Na2CO3和盐酸
B.AlCl3和NaOH
C.NaAlO2和硫酸
D.Na2CO3和BaCl2
参考答案:D
本题解析:
本题难度:一般
5、填空题 某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示:

⑴粉碎后的铝土矿碱浸时应在高温下进行,其目的是?。
⑵AlO(OH)与NaOH反应的化学方程式为?。
⑶在稀释、结晶过程中:稀释的目的是?;加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的?气体的方法来代替。
⑷浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:?。
⑸该生产流程能实现?(填化学式)的循环利用。
参考答案:
⑴加快反应的速率
⑵AlO(OH) +NaOH=NaAlO2+H2O
⑶促进NaAlO2的水解? CO2
⑷Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑸NaOH
本题解析:(1)高温有利于加快反应速率;(2)AlO(OH)与NaOH反应的同样应是偏铝酸钠,AlO(OH) +NaOH=NaAlO2+H2O;(3)该过程是通过NaAlO2的稀释生成Al(OH)3,没有其它反应物,故其应该是水解产生,稀释促进NaAlO2的水解,也可以用CO2与其反应利用强酸制弱酸生成氢氧化铝;(4)加入熟石灰生成碳酸钙除去;(5)NaOH碱浸时使用,最后过滤时产生,故是循环利用。
本题难度:一般