微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中,通入的气体物 质只作为氧化剂的是
质只作为氧化剂的是
A.二氧化硫通入氢硫酸中
B.氯气通入NaOH溶液中
C.少量氯气通入氯化亚铁酸性溶液 中
中
D.硫化氢通入溴水中
参考答案:AC
本题解析:略
本题难度:一般
2、填空题 (6分)1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
参考答案:2:1;80%;640
本题解析:(1)金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为1.02g÷17g/mol=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1;
(2)NO2和N2O4混合气体的物质的量为1.12L÷22.4L/mol=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,所以NO2和N2O4的混合气体中,NO2的体积分数是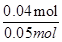 ×100%=80%;
×100%=80%;
(3)反应后溶质为硝酸钠,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)=0.64mol,故需要氢氧化钠溶液的体积为0.64mol÷1mol/L=0.64L=640mL。
考点:考查镁铜合金与硝酸反应的有关计算
本题难度:一般
3、选择题 下列变化中,需加入还原剂的是?(?)
A.2Cl- → Cl2
B.Fe3+→Fe2+
C.NH4+ → NH3
D.HCO3- →CO2
参考答案:B
本题解析:加入还原剂,说明本身被还原,化合价降低。化合价降低的只有B。
本题难度:简单
4、选择题 下列有关硬 水的说法中,不正确的是
水的说法中,不正确的是
A.含有较多钙、镁离子的水叫做硬水
B.硬水会降低肥皂的洗涤效果
C.可以采取加热煮沸法和离子交接法软化硬水
D.软水中不含有钙、镁离子
参考答案:D
本题解析:略
本题难度:简单
5、选择题 在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:3Sn2++2H3AsO3+6H++18Cl-==2As+3SnCl62-+6M。关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As
③每生成1 mol As,反应中转移电子的物质的量为3 mol
④M为OH- ⑤SnCl62-是氧化产物
A.①②④⑤
B.①③⑤
C.①②③④
D.只有①③