微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、E、F为原子序数依次增大的六种元素,其中A、B、C、D、E为短周期元素,F为第四周期元素,F还是前四周期中电负极最小的元素。
已知:
A原子的核外电子数与电子层数相等;
B元素原子的核外p电子数比s电子数少1个;
C原子的第一至第四电离能为I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol;
D原子核外所有p轨道为全充满或半充满;
E元素的族序数与周期序数的差为4;
(1)写出E元素在周期表位置:________;D元素的原子的核外电子排布式:____________________。
(2)某同学根据题目信息和掌握的知识分析C的核外电子排布为
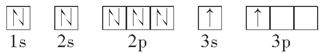
该同学所画的轨道式违背了________。
(3)已知BA5为离子化合物,写出其电子式:______________。
(4)DE3中心原子杂化方式为__________________,其空间构型为______________。
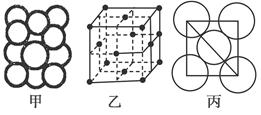
(5)某金属晶体中原子堆积方式如图甲,晶胞特征如图乙,原子相对位置关系如图丙,则晶胞中该原子配位数为________;空间利用率为________;该晶体的密度为________。(已知该金属相对原子质量为m,原子半径为a cm)
参考答案:(1)第三周期ⅦA族 1s22s22p63s23p3
(2)能量最低原理
(3) 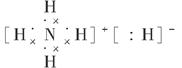 ?
?
(4)sp3 三角锥形
(5)12 74% 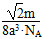 g/cm3
g/cm3
本题解析:(1)由题意分析知F为K;A为H;B为N;由电离能知C的+2价稳定,为Mg;D为P;E为Cl。(2)原子的核外电子分能级排布,按构造原理先排能量低的能级,再排能量高的能级,遵循能量最低原理时,该原子才最稳定。该同学未排满3s能级,就排3p能级,违背了能量最低原理。(3)NH5为离子化合物,则为铵盐,存在NH4+和H-。(4)PCl3中心原子P上的价层电子对=3+ ?(5-3×1)=4,杂化类型为sp3杂化;存在一个孤电子对,故分子构型为三角锥形。(5)由图可知:该金属堆积方式为面心立方最密堆积,原子配位数为12,空间利用率为74%;由图乙可知每个晶胞中含有的原子数为8×
?(5-3×1)=4,杂化类型为sp3杂化;存在一个孤电子对,故分子构型为三角锥形。(5)由图可知:该金属堆积方式为面心立方最密堆积,原子配位数为12,空间利用率为74%;由图乙可知每个晶胞中含有的原子数为8× +6×
+6× =4。设晶胞的棱长为x,由图丙知x2+x2=(4a)2,x=2
=4。设晶胞的棱长为x,由图丙知x2+x2=(4a)2,x=2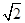 a,若该晶体的密度为ρ,则
a,若该晶体的密度为ρ,则 。
。
点拨:本题考查物质结构与性质,考查考生对物质结构与性质的掌握情况。难度较大。
本题难度:一般
2、选择题 金星的大气中有一种称为硫化羰(COS)的分子,其结构与CO2类似,有关COS化学用语正确的是
A.
B.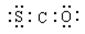
C.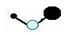
D.O="C=S"
参考答案:D
本题解析:A.硫化羰(COS)的分子,其结构与CO2类似,为直线形分子,但氧原子和硫原子的半径不相等,故A错误;B.COS分子电子式为 ,故B错误;C.硫化羰(COS)的分子,其结构与CO2类似,为直线形分子,不是V形分子,故C错误;D.二氧化碳是结构简式为O=C=O,所以硫化羰(COS)的分子的结构简式为O=C=S,故D正确;故选D。2的结构,硫化羰(COS)的分子的电子式、结构式、球棍模型、比例模型,培养了学生分析问题、运用知识解决问题的能力。
,故B错误;C.硫化羰(COS)的分子,其结构与CO2类似,为直线形分子,不是V形分子,故C错误;D.二氧化碳是结构简式为O=C=O,所以硫化羰(COS)的分子的结构简式为O=C=S,故D正确;故选D。2的结构,硫化羰(COS)的分子的电子式、结构式、球棍模型、比例模型,培养了学生分析问题、运用知识解决问题的能力。
本题难度:一般
3、选择题 X、Y、Z为短周期元素,原子序数依次增大.X的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X和Z在同一主族.下列叙述不正确的是( )
A.原子半径:Y>Z
B.X元素的一种单质可用于消毒杀菌
C.Y的氧化物是工业制取Y单质的主要原料
D.Z的单质在氧气中点燃可生成两种酸性氧化物
参考答案:的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,则应为第二周期元素,Y为第三周期元素,设X的最外层电子数为2x,则Y的最外层电子数为x,则有(2+8+x)-5=2+2x,x=3,则X的原子序数为8,为O元素,Y的原子为13,为Al元素,X和Z在同一主族,则Z为S元素,则
A.Y为Al元素,Z为S元素,位于相同周期,原子半径Al大于S,故A正确;
B.X为O元素,对应的单质03可用于消毒杀菌,故B正确;
C.工业常用电解氧化铝的方法冶炼铝,故C正确;
D.S在氧气中燃烧只生成SO2,在催化剂的条件下与氧气反应生成SO3,故D错误.
故选D.
本题解析:
本题难度:简单
4、选择题 下列说法中,正确的是?
[? ]
A、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
B、离子化合物中只有离子键,共价化合物中只有共价键
C、氨分子中氢、氮原子的化合价已饱和,不能再与其它原子或离子成键
D、铵根离子呈正四面体结构
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列说法不正确的是
A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关
B.H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键
C.乙醇与水互溶可以用相似相溶原理解释
D.甲烷与水分子间不能形成氢键这种化学
参考答案:D
本题解析:A、HCl、HBr、HI三种物质形成的晶体均是分子晶体,其熔点沸点升高与范德华力大小有关,A正确;B、由于水分子间存在氢键,因此H2O的熔点沸点大于H2S的沸点,B正确;C、乙醇和水都是极性分子,因此乙醇与水互溶可以用相似相溶原理解释,C正确;D、甲烷不能形成氢键,D不正确,答案选D。
本题难度:一般