| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《盐类水解的原理》高频试题预测(2017年最新版)(六)
参考答案:A 本题解析:A.由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成的溶液,电离的CH3COOH与NaOH反应,仍可以继续电离使溶液呈酸性,且溶液中只有Na+、CH3COO-、H+、OH-四种离子;B.由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成,CH3COOH与NaOH恰好反应生成CH3COONa,溶液水解呈碱性;C.溶液中 离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒;D.加入大量的氨水,c(NH 本题难度:一般 3、选择题 表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的 |
参考答案:B
本题解析:试题分析:A.由电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) ,故A错误。B.由原子守恒可知:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确。C.因NaHCO3溶液中HCO3-的水解程度大于其电离程度,其溶液呈碱性即c(OH-) >c(H+),故C错误。D.由质子守恒可得c(OH-)+c(CO32-)=c(H+)+c(H2CO3),故D错误。
考点: 了解电解质在水溶液中的电离、盐类水解的原理
点评:此类题目注重电解质溶液中的“三”守恒规律的应用:
(一)电荷守恒: 1.要找全溶液中离子 2.分清离子浓度和电荷浓度;
(二)物料守恒: 1.要找出电解质中原子的个数关系 2.等量代换;
(三)质子守恒: 1.要明确溶液中那些微粒结合H+(或OH-),结合的数目 2.那些微粒电离出H+(或OH-),电离的数目。
本题难度:一般
4、填空题 (13分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.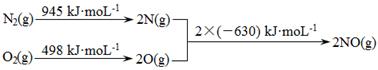
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2=" -565" kJ·mol-1
2CO2 (g) ΔH2=" -565" kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 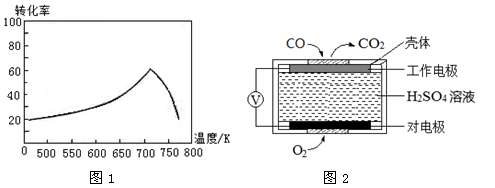
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因 。
参考答案:(13分,未标分数的空每空2分,合理即给分)
(1)①+183kJ·mol-1
②2CO(g)+2NO(g) 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1
③温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低
(2)①CO-2e-+H2O CO2+2H+
CO2+2H+
②2NO+3H2O2 2NO3-+2H2O+2H+
2NO3-+2H2O+2H+
(3)NH4HSO3(1分)
HSO3- H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
本题解析:(1)①化学反应的焓变等于反应物的键能之和减去生成物的键能之和,根据信息Ⅰ中的数据计算反应N2(g)+ O2(g)  2NO(g)的ΔH1=+183kJ·mol-1。②在催化剂作用下NO和CO转化为无毒气体N2和CO2,利用信息II.i N2(g)+ O2(g)
2NO(g)的ΔH1=+183kJ·mol-1。②在催化剂作用下NO和CO转化为无毒气体N2和CO2,利用信息II.i N2(g)+ O2(g)  2NO(g) ΔH1=+183kJ·mol-1,ii 2CO(g) + O2(g)
2NO(g) ΔH1=+183kJ·mol-1,ii 2CO(g) + O2(g) 2CO2 (g) ΔH2=" -565" kJ·mol-1,根据盖斯定律:ii—i得反应的热化学方程式为2CO(g)+2NO(g)
2CO2 (g) ΔH2=" -565" kJ·mol-1,根据盖斯定律:ii—i得反应的热化学方程式为2CO(g)+2NO(g) 2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1;③温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低。(2)①CO传感器的工作原理为酸性CO燃料电池,CO发生氧化反应,在原电池的负极参加反应,电极反应式为CO-2e-+H2O
2CO2 (g)+N2 (g) ΔH=-748 kJ·mol-1;③温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低。(2)①CO传感器的工作原理为酸性CO燃料电池,CO发生氧化反应,在原电池的负极参加反应,电极反应式为CO-2e-+H2O CO2+2H+,O2发生还原反应,作正极,电极反应式为O2+4e-+4H+==2H2O;② NO与H2O2溶液反应生成硝酸和水,离子方程式为2NO+3H2O2
CO2+2H+,O2发生还原反应,作正极,电极反应式为O2+4e-+4H+==2H2O;② NO与H2O2溶液反应生成硝酸和水,离子方程式为2NO+3H2O2 2NO3-+2H2O+2H+;(3)相同条件下,同浓度的NaHSO3、NH4HSO3的水溶液中c(SO32-)较小的是NH4HSO3,原因HSO3-
2NO3-+2H2O+2H+;(3)相同条件下,同浓度的NaHSO3、NH4HSO3的水溶液中c(SO32-)较小的是NH4HSO3,原因HSO3- H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
H+ +SO32-,NH4+水解使c(H+)增大,电离平衡逆向移动,c(SO32-)浓度减小。
考点:考查反应热的计算、盖斯定律,化学平衡,燃料电池及电解质溶液中的离子平衡。
本题难度:困难
5、选择题 相同物质的量浓度的下列物质的水溶液,碱性最强的是
A.NaNO3
B.Na2CO3
C.Na2SiO3
D.CH3COONa
参考答案:C
本题解析:硅酸酸性在题干答案对应的酸中最弱,硅酸盐水解程度最大,碱性最强.
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《有机化学反.. | |