| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应速率》考点巩固(2017年最新版)(十)
参考答案:B 本题解析:A、强酸与强碱的反应迅速,所以活化能接近于零,反应速率很高,正确;B、过程的自发性只能用于判断过程的方向,不能判断反应速率的变化,错误;C、电解质溶液导电的实质是电解质溶液中的自由离子发生反应,所以电解质溶液导电过程中,一定发生电解质溶液的电解,正确;D、溶解度较小的硫酸钡在一定条件下也可以转化为溶解度较大的碳酸钡,如向硫酸钡的饱和溶液中加入浓度较大的碳酸钠溶液,正确,答案选B。 本题难度:一般 4、选择题 一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 参考答案:B 本题解析:A.t1 min时反应物H2、生成物NH3的物质的量浓度相等,但是由于化学反应速率是平均速率,所以不能说正、逆反应速率相等。错误。B.由图像可知X是生成物,在该反应则只有NH3。根据坐标中横轴、纵轴的含义可知X曲线表示NH3的物质的量随时间变化的关系。正确。C.0~8 min,H2的平均反应速率v(H2)=(1.2-0.3)mol÷10L÷8min="0.01" mol·L-1·min-1 .错误。D.10~12 min,H2的物质的量减小,NH3的物质的量增大,平衡正向移动,最终到12min时达到新的平衡状态。若是升高温度,反应速率加快,则由于该反应的正反应是放热反应,平衡应该向逆反应方向移动,H2的物质的量增大,NH3的物质的量减小,。与图像不符合。错误。 本题难度:一般 5、选择题 一定温度下,有可逆反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2?(g)△H>0,以下说法中正确的是( )
C.增大压强后,V正、V逆如图所示 D.利用该反应原理可以在铁表面附上一层保护层,减少铁的腐蚀 |
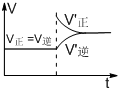
参考答案:A.反应吸热,升高温度平衡向正反应方向移动,H2O(g)的转化率增大,故A正确;
B.反应的化学平衡常数的表达式为k=c(H2)4c(H2O)4,故B错误;
C.增大压强,正逆反应速率都增大,由于反应前后气体的化学计量数之和相等,则平衡不移动,故C错误;
D.利用该反应原理可以在铁表面生成一层致密的Fe3O4,起到保护层的作用,故D正确.
故选AD.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《有关氧化还.. | |