微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关说法正确的是( )
A.原子的最外层有两个电子的元素都在第ⅡA族
B.第ⅠA族元素都是典型的金属元素
C.氟、氯、氧、氮四种元素都是第ⅦA族的元素
D.第三周期的元素的原子核外都有三个电子层
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列能级或电子层按能量由低到高的顺序排列,不正确的是
[? ]
A.1s、2s、3s、4s
B.K、 L、M、N
C.3s、3p、3d
D.2p、4s、3d、5f
参考答案:D
本题解析:
本题难度:简单
3、填空题 现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相等的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.请回答下列问题:
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式______;同主族的第四周期元素基态原子的外围电子排布式为______.
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序:______.
(3)上述六种物质或粒子中互为等电子体的是______(写出化学式).
(4)F分子的中心原子杂化类型是______,F易溶于E,其原因是______.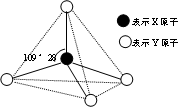
参考答案:A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有正四面体结构或结构单元,D是阳离子,故D为NH4+;C、D、E、F含有相等的电子数,故电子数为10,D与F的组成元素相同,故F为NH3;由E构成的物质常温下呈液态,故E为H2O;C、E、F的晶体类型相同,属于分子晶体,故C为CH4;A、B的晶体类型相同.单质A的同素异形体能与B物质发生置换反应,A为金刚石,B为二氧化硅.
(1)碳与二氧化硅反应生成硅与一氧化碳,反应方程式为SiO2+2C?高温?.?Si+2CO↑;同主族的第四周期元素基态原子的外围电子排布式为4s24p2.
故答案为:SiO2+2C?高温?.?Si+2CO↑;4s24p2.
(2)上述六种物质或粒子的组成元素中C、N、O三种处于同一周期,同周期自左而右等于电离能增大,但N元素的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故C、N、O三元素第一电离能由大到小的顺序:N>O>C.
故答案为:N>O>C.
(3)原子数相同,电子数目相同的为等电子体,CH4、NH4+?是等电子体.
故答案为:CH4、NH4+.
(4)F分子是NH3,中心原子N原子成3个σ键,含有1对孤对电子,杂化轨道数为4,采取sp3杂化;NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键,所以氨气易溶于水.
故答案为:sp3杂化;NH3和H2O为极性分子符合相似相溶原理,且NH3和H2O分子之间能形成氢键.
本题解析:
本题难度:一般
4、选择题 下列取代基或微粒中,碳原子都满足最外层为8电子结构的是( )
A.乙基(-CH2CH3)
B.碳正离子[(CH3)3C+]
C.碳化钙?(CaC2)
D.碳烯?(:CH2)
参考答案:A、-CH2CH3中CH3中碳形成4对共用电子对,满足8电子.CH2中碳原子不满足,与碳原子形成1对共用电子对,与氢原子共形成2对共用电子对,含有1个单电子,最外层电子数为4+3=7,故A不符合;
B、(CH3)3C+中CH3中碳形成4对共用电子对,满足8电子.中心碳原子与另三个碳原子形成3对共用电子对,且中心碳原子失去一个电子,最外层电子数为4+3-1=6,故B不符合;
C、碳化钙中,碳原子之间形成碳碳叁键,每个碳原子形成3个共用电子,钙原子为每个碳原子提供1个电子,碳原子最外层都是为4+3+1=8,故C符合;
D、碳原子与两个氢原子形成2对共用电子对,碳原子最外层电子数为4+2=6,故D不符合.
故选:C.
本题解析:
本题难度:一般
5、选择题 下列各项叙述中,正确的是
[?]
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是S区元素
C.所有原子任一能层的S电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是:1s22s22p63s23p63d44s2
参考答案:C
本题解析:
本题难度:简单