微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述相符的是?
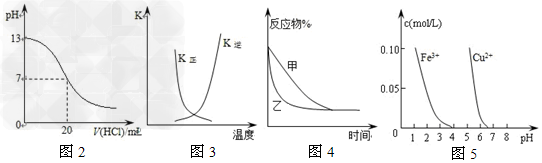
[? ]
A.图2表示25℃时,用0.1?mol/L盐酸滴定20?mL?0.1?mol/LNaOH溶液,溶液的pH随加入酸体积的变化
B.图3中曲线表示反应2A(g)?+?B(g) 2C(g)?ΔH?>?0,正、逆反应的平衡常数K随温度的变化
2C(g)?ΔH?>?0,正、逆反应的平衡常数K随温度的变化
C.图4表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图5,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:
本题难度:一般
2、填空题 已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,且Ksp(AgX)=1.8×10-10,Ksp(AgY)=1.0×10-12,Ksp(AgZ)=8.7×10-17。
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(已被溶解的溶质的物质的量/1 L溶液)S(AgX)、S(AgY)、S(AgZ)的大小顺序为_________________ _____________________________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大”“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,________(填“能”或“不能”),理由为_______________________________。
参考答案:(1)S(AgX)>S(AgY)>S(AgZ)
(2)减小
(3)1.0×10-6 mol·L-1
(4)能 Ksp(AgY)=1.0×10-12>Ksp(AgZ)=8.7×10-17
本题解析:
(1)由于AgX、AgY、AgZ为同一类型的盐,所以其溶解度大小可以根据Ksp大小予以确定,因为Ksp(AgX)>Ksp(AgY)>Ksp(AgZ),所以S(AgX)>S(AgY)>S(AgZ)。
(2)向AgY的饱和溶液中加入少量的AgX固体,由于AgX的溶解度大于AgY,溶液中的c(Ag+)增大,AgY溶解平衡向着生成沉淀的方向移动。
(3)AgY饱和溶液中,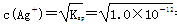 =1.0×10-6 mol·L-1,AgY固体完全溶解后c(Ag+)=10-2 mol·L-1,故0.188 g AgY不能完全溶解,其溶液中c(Y-)=1.0×10-6 mol·L-1。
=1.0×10-6 mol·L-1,AgY固体完全溶解后c(Ag+)=10-2 mol·L-1,故0.188 g AgY不能完全溶解,其溶液中c(Y-)=1.0×10-6 mol·L-1。
(4)因Ksp(AgY)=1.0×10-12>Ksp(AgZ)=8.7×10-17,所以能够实现AgY向AgZ的转化。
本题难度:一般
3、计算题 氢氧化镁难溶于水,但它所溶解的那一部分在溶液中完全电离。t ℃时,某饱和氢氧化镁溶液的pH=11,若不考虑KW值的变化,则该温度下的氢氧化镁的溶解度是。
参考答案:0.002 9 g
本题解析:pH=11,则c(OH-)="0.001" mol·L-1,所以,c〔Mg(OH)2〕="0.000" 5 mol·L-1,即1 000 g水中可溶解0.000 5 mol的Mg(OH)2,即S="0.000" 5×58 g="0.002" 9 g。
本题难度:简单
4、选择题 难溶电解质AB2饱和溶液中,c(A+)=x mol·L-1,c(B-)=y mol·L-1,则Ksp值为
[? ]
A.1/2xy2
B.xy
C.xy2
D.4xy2
参考答案:C
本题解析:
本题难度:一般
5、选择题 在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中
[? ]
A.Br-浓度降低
B.Ag+浓度降低
C.Kw减小
D.Ksp(AgBr)增大
参考答案:A
本题解析:
本题难度:一般