微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
已知CO(g)+H2O(g) CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
CO2(g)+H2(g)反应的平衡常数和温度的关系如下:
|温度/ ℃
| 700
| 800
| 830
| 1000
| 1200
|
平衡常数
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
|
回答下列问题:
(1)该反应的△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的CO和0.80mol的H2O,反应初始6s内CO的平均反应速率v(CO)="0.003" mol·L-1·s-1,则6S末CO2的物质的量浓度为 ;反应经一段时间后,达到平衡后CO的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(CO)不随时间改变 d.单位时间里生成CO和H2的物质的量相等
(4)已知1000℃时,要使CO的转化率超过90%,则起始物c(H2O): c(CO)应不低于 ;
(5)某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式 ;
(6)已知CO可用于制备很多物质:
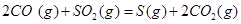 ΔH=+8.0kJ·mol-1
ΔH=+8.0kJ·mol-1
 ΔH=+90.4kJ·mol-1
ΔH=+90.4kJ·mol-1
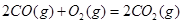 ΔH=-556.0kJ·mol-1
ΔH=-556.0kJ·mol-1
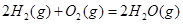 ΔH=-483.6kJ·mol-1
ΔH=-483.6kJ·mol-1
请写出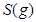 与
与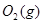 反应生成
反应生成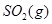 热化学方程式 。
热化学方程式 。
参考答案:(每空2分)
(1) < (2分) (2)0.018 mol·L-1 80% (各2分) (3)c d(2分)
(4)14.4(2分)
(5)正极:O2 + 4e- + 2CO2 = 2CO32-(2分)
(6)S(g)+O2(g)= SO2(g) ΔH=-574.0kJmol-1(2分)
本题解析:(1)由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,故正反应是放热反应,即△H<0。
(2)反应初始6s内A的平均反应速率v(CO)=0.003mol?L-1?s-1,则6s内c(CO2)=△c(CO)=0.003mol?L-1?s-1×6s=0.018mol?L?1;CO的起始浓度=0.2mol/5L=0.04mol?L?1。
设平衡时A的浓度变化量为x,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故x?x/(0.04?x)(0.16?x) =1,解得x=0.032mol/L,所以平衡时A的转化率=0.032mol/L ÷0.04mol?L?1×100%=80%
(3)a、该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,错误;b、混合气体的总质量不变,容器的容积不变,故混合气体的密度始终不变,故气体的密度不随时间改变,不能说明到达平衡,错误;c、可逆反应到达平衡时,各组分的浓度不发生变化,故c(CO)不随时间改变,说明到达平衡,正确;d、单位时间里生成CO和H2的物质的量相等,正反应速率等于逆反应速率,说明到达平衡,正确。
(4)设CO、H2O的起始浓度分别为x、y,且CO的转化率为90%,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol?L-1) x y 0 0
转化浓度(mol?L-1) 0.9x 0.9x 0.9x 0.9x
平衡浓度(mol?L-1) 0.1x y-0.9x 0.9x 0.9x
K=0.9x?0.9x ÷[0.1x?(y?0.9x)] =0.6,得y/x=14.4,只要增加H2O量,就可提高CO的转化率。
(5)该电池中,正极反应一定是氧气得电子的过程,该电池的电解质环境是熔融碳酸盐,所以电极反应为:O2+2CO2+4e-=2CO32- (或2O2+4CO2+8e-=4CO32-)
(6)根据盖斯定律:S(g)+O2(g)=SO2(g)可由已知反应(③+④-①-②)/2得到,则S(g)与O2(g)反应生成SO2(g)热化学方程式为:S(g)+O2(g)=SO2(g)△H=-574.0kJmol-1。
考点:本题考查化学平衡判断及移动分析、化学反应速率、原电池原理、热化学方程式书写。
本题难度:一般
2、选择题 镁燃料电池作为一种高能化学电源,具有良好的应用前景。下图是镁一空气燃料电池工作原理示意图。下列有关该电池的说法正确的是
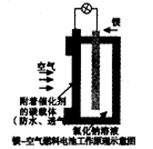
A.该电池Mg作负极,发生还原反应
B.该电池的正极反应式为:
C.电池工作时,电子通过导线由碳电极流向Mg电极
D.当电路中通过0.2mol电子时,消耗的O2体积为1.12L
参考答案:B
本题解析:该电池Mg做负极,工作时发生氧化反应,A项错;在电池正极上O2得电子被还原为OH-,B项正确;电池工作时,外电路中电子由负极流向碳电极(正极),C项错;D项,没有给出氧气所处状态,无法确定其体积。
本题难度:一般
3、选择题 如图所示,下列叙述正确的是( )
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.SO42-?从左侧移向右侧
D.X为阳极,与滤纸接触处变红
