微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.3 mol Cu2S和足量HNO3反应生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的HNO3中未被还原的HNO3的物质的量为(?)
A.2.2 mol
B.1.2 mol
C.1.0 mol
D.0.6 mol
参考答案:B
本题解析:根据Cu元素守恒和化学式Cu(NO3)2,知未被还原的硝酸:
n(HNO3)=2n〔Cu(NO3)2〕=2n(Cu2+)=2×0.3 mol×2="1.2" mol。
本题难度:简单
2、选择题 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于3 区域的是
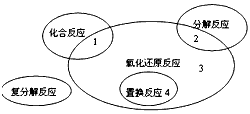
[? ]
A.Cl2+2KBr==Br2+2KCl
B.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O==4Fe(OH)3
D.2Na2O2+2CO2==2Na2CO3+O2
参考答案:D
本题解析:
本题难度:简单
3、选择题 三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2===NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是( )
A.制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1
B.在NF3与H2O的反应中,H2O作还原剂
C.若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D.NF3在空气中一旦泄漏,不易于发现
参考答案:A
本题解析:根据4NH3+3F2===NF3+3NH4F可知,氧化剂与还原剂的物质的量之比为3∶1,0.5 mol NH3参加反应,转移电子的物质的量为0.75 mol。根据NF3能与水蒸气反应生成HF、NO和HNO3可知H2O没有参与氧化还原反应,如果NF3泄漏,必然与空气中的水蒸气反应生成NO,NO被氧化成NO2,空气中有红棕色气体生成,易被发现。答案选A。
点评:本题根据信息来分析氧化还原反应反应,题型新颖,难度适中。
本题难度:一般
4、填空题 (7分)黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用做食盐添加剂(抗结剂),我国卫生部规定食盐中黄血盐的最大使用量为10mg·kgˉ1。黄血盐易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4ˉ,其中CNˉ的电子式为 。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O
。它与硫酸反应的化学方程式为K4Fe(CN)6+6H2SO4+6H2O 2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
2K2SO4+FeSO4+3(NH4)2SO4+6CO↑
(1)上述反应是否为氧化还原反应?______ (填“是”或“不是”)。
(2)食盐经长时间火炒,“亚铁氰化钾”名称前的“亚铁”就去掉了,变成了剧毒物质氰化钾,这是因为黄血盐在超过4000C时会分解,试配平该反应的化学方程式:
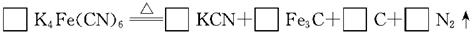
(3) 黄血盐可与高锰酸钾溶液反应,其化学方程式为
K4Fe(CN)6+ KMnO4+ H2SO4→KHSO4+ Fe2(SO4)3+MnSO4+HNO3+CO2↑+H2O(未配平)
①该反应的氧化产物有___?___(填化学式)。
②若有1mol K4Fe(CN)6被高锰酸钾氧化,则消耗高锰酸钾的物质的量为____?__mol。
参考答案:(7分)⑴不是(1分) ⑵3,12,1,5,3(2分)⑶①Fe(SO4)3 、HNO3、CO2 (2分)
②12.2(2分)
本题解析:(1)f反应中元素的化合价都没有发生变化,所以不是氧化还原反应。
(2)根据原子守恒可以进行配平。
(3)化合价升高的元素是铁元素、碳元素和氮元素,所以氧化产物是Fe(SO4)3 、HNO3、CO2。1mol K4Fe(CN)6在反应中失去电子是(1+2×6+8×6)mol=61mol,所以根据电子的得失守恒可知,消耗高锰酸钾的物质的量为61mol÷5=12.2mol.
本题难度:一般
5、填空题 (7分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4? B. H2O2 ? C. Cl2水? D. HNO3?
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去
Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH? B. NH3·H2O? C. CuO? D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(7分)(1)B? CD (2)4? 3.3?可行
本题解析:(1)除杂的过程中不能引进新的杂质,H2O2为绿色氧化剂,产物为水;调节溶液pH不能引进新的杂质,用? CuO和Cu(OH)2即可。
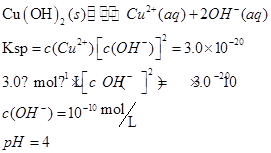
(2)
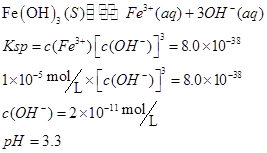
方案可行。
本题难度:一般