微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 [2012·漳州质检]已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确的是(?)
A.反应生成物都属于电解质
B.HCl全部发生氧化反应
C.该反应表明氧化性KClO3比Cl2强
D.1mol KClO3在反应中得到6mole-
参考答案:C
本题解析:反应生成物中的Cl2属于单质,既不是电解质,也不是非电解质,A项错;根据氧化还原反应的归中规律知,KClO3中的Cl由+5价降至0价,故1mol KClO3在反应中得到5mole-,D项错;每6molHCl参加反应,只有5molHCl被氧化,B项错;该反应中KClO3是氧化剂,Cl2既是氧化产物又是还原产物,故氧化性KClO3比Cl2强,C项正确。
本题难度:简单
2、选择题 Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32﹣和Cl2反应的产物之一为SO42﹣.下列说法不正确的是( )
A.该反应中还原剂是S2O32﹣
B.H2O参与该反应,且作氧化剂
C.根据该反应可判断氧化性:Cl2>SO42﹣
D.上述反应中,每生成l mol SO42﹣,可脱去2mol Cl2
参考答案:B.
本题解析:反应的离子方程式为S2O32﹣+4Cl2+10OH﹣=2SO42﹣+8Cl﹣+5H2O,则A.反应中S元素的化合价升高,被氧化,则S2O32﹣为还原剂,故A正确;B.反应中H2O为产物,不是氧化剂,氧化剂为反应物,故B错误;C.氧化剂氧化性大于氧化产物的氧化性,反应中氧化性:Cl2>SO42﹣,故C正确;D.由反应的方程式可知,每生成lmolSO42﹣,可脱去2molCl2,故D正确.
本题难度:一般
3、选择题 下列反应中,属于有水参加的氧化还原反应,且水只作氧化剂的是(?)
A.SO2+H2O====H2SO3
B.Cl2+H2O====HCl+HClO
C.2H2O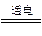 2H2↑+O2↑
2H2↑+O2↑
D.3Fe+4H2O(g)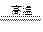 Fe3O4+4H2↑
Fe3O4+4H2↑
参考答案:D
本题解析:A项属非氧化还原反应;B项属氧化还原反应,但水既不作氧化剂也不作还原剂;C项水既作氧化剂又作还原剂;D项水作氧化剂,铁作还原剂,故选D。
本题难度:简单
4、选择题 水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O,下列说法中,正确的是
A.Fe2+和S2O32—都是还原剂
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.每生成1mol Fe3O4,反应转移的电子总数为3mol
参考答案:A
本题解析:A、根据方程式3Fe2++2S2O32-+O2+xOH—=Fe3O4+S4O62-+2H2O可知,铁元素和硫元素的化合价升高,因此Fe2+和S2O32—都是还原剂,A正确;B、根据氢原子守恒可知,反应的离子方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,即x=4,故B错误;C、1molFe2+被氧化时,失去1mol电子,则被Fe2+还原的O2的物质的量为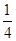 mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。
mol,C不正确;D、反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe和S元素的化合价升高,被氧化,O2为氧化剂,每生成1molFe3O4,反应转移的电子总数为4mol,故D不正确,答案选A。
本题难度:一般
5、填空题 工业上制取冰晶石(Na3AlF6)的化学方程式如下,
2Al(OH)3+ 12HF+ 3Na2CO3=2Na3AlF6+ 3CO2↑+ 9H2O,根据题意完成下列填空:
(1)在上述反应的反应物和生成物中,属于非电解质的物质的电子式为?,属于弱酸的电离方程式?。
(2)上述反应物中有两种元素在元素周期表中位置相邻,下列能判断它们的金属性或非金属性强弱的是?(选填编号)。
a.气态氢化物的稳定性? b.最高价氧化物对应水化物的酸性
c.单质与氢气反应的难易? d.单质与同浓度酸发生反应的快慢
(3)上述反应物中某些元素处于同一周期。它们最高价氧化物对应的水化物之间发生反应的离子方程式为?。
(4)上述产物当中有一个物质比同族元素类似化合物的沸点高很多,写出这个物质的结构式_______,其沸点较高的原因是_______________;反应物中属于盐的物质中含有的化学键有________________。(填“离子键”或“共价键”或“金属键”)
参考答案:
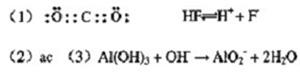
(4)H-O-H,分子间存在氢键,离子键和共价键
本题解析:略
本题难度:简单