微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Cu2S + 2Cu2O =6Cu + SO2↑反应中,下列说法正确的是?(?)
A.生成1molCu,转移2mol电子
B.Cu是氧化产物
C.Cu2S既是氧化剂又是还原剂
D.氧化剂只有Cu2O
参考答案:C
本题解析:根据方程式可知,Cu2S中Cu的化合价从+1价降低到0价,S的化合价从-2价升高到+4价,所以Cu2S既是氧化剂,也是还原剂。Cu2O中Cu的化合价从+1价降低到0价,因此Cu2O是氧化剂。所以选项BD是错误的,C正确。A不正确,生成1molCu,转移1mol电子,答案选C。
本题难度:简单
2、选择题 溴的氧化性介于氯和碘之间。利用这一性质判断,下列说法正确的是(?)
A.Cl—、I—离子加入到含Br—的溶液中,均可以将Br—氧化为Br2
B.将Cl2缓慢通入含有相同物质的量浓度的Br—、I—的混合溶液中,Br—先被氧化
C.湿润的淀粉碘化钾试纸遇到氯气会变蓝色
D.在KBr溶液中加入碘水,发生如下反应:2Br—+I2=2I—+Br2
参考答案:C
本题解析:A项Cl—、I—不具有氧化性,不能将Br—氧化为Br2氧化,A项错误;B项由于I—的还原性强于Br—,所以I—先被氧化;C项Cl2能将碘离子氧化为碘单质,所以能使淀粉变蓝色,C项正确;D项因I2的氧化性弱于Br2不能进行此反应,D项错误。
本题难度:一般
3、填空题 甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤
| 操作
| 现象
|
I
| 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液
| 溶液由棕黄色变为红褐色,
并有少量刺激性气味的气体逸出
|
?
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
Fe3+ + SO32- +
SO32- + ?=
?= F e2+ +
F e2+ + ??+
??+ ?
?
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
|
?
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤
| 操作
| 现象
|
II
| 用激光笔照射步骤I中的红褐色溶液
| 出现“丁达尔效应”
|
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤
| 操作
| 现象
|
III
| 向1 mol?L-1的FeCl3溶液中通入一定量的SO2
| 溶液由黄色变为红褐色
|
IV
| 用激光笔照射步骤III中的红褐色溶液
| 没有出现“丁达尔效应”
|
?
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液?b.KSCN溶液?c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因:?。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
参考答案:(1)<(2)①Fe3++3H2O Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3②2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”(4)①a ②H2SO3
Fe(OH)3+3H+,加入Na2SO3后,c(H+)下降,平衡正向移动,生成Fe(OH)3②2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)FeSO3和FeCl3的混合溶液也可能出现“丁达尔效应”(4)①a ②H2SO3 H++HSO3—;HSO3—
H++HSO3—;HSO3— H++SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
H++SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色
本题解析:(1)铁离子在溶液中水解生成Fe(OH)3产生H+,故溶液pH<7;(2)①溶液中铁离子水解生成Fe(OH)3产生红褐色沉淀,Fe3++3H2O Fe(OH)3+3H+,加入Na2SO3后,SO32-与H+反应生成SO2,使溶液中c(H+)下降,平衡正向移动,促进水解进行②2Fe3++SO32-+H2O = 2Fe2++SO42+2H+②由题意知铁元素的化合价降低,生成亚铁离子,硫元素化合价升高生成硫酸根离子,故反应方程式2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)由查阅到的资料可知墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,也可产生“丁达尔现象”故无法确定是否为Fe(OH)3(4)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,故a正确 ②H2SO3分步电离生成SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色,H2SO3
Fe(OH)3+3H+,加入Na2SO3后,SO32-与H+反应生成SO2,使溶液中c(H+)下降,平衡正向移动,促进水解进行②2Fe3++SO32-+H2O = 2Fe2++SO42+2H+②由题意知铁元素的化合价降低,生成亚铁离子,硫元素化合价升高生成硫酸根离子,故反应方程式2Fe3+ + SO32- +H2O = 2Fe2+ +SO42-+2H+(3)由查阅到的资料可知墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色,也可产生“丁达尔现象”故无法确定是否为Fe(OH)3(4)①亚铁离子和铁氰化钾溶液反应生成蓝色沉淀,这是亚铁离子的特征反应,故a正确 ②H2SO3分步电离生成SO32—,SO32—与被还原生成的Fe2+结合为FeSO3,与剩余的FeCl3溶液混合而呈现红褐色,H2SO3 H++HSO3—,HSO3—
H++HSO3—,HSO3— H++SO32—,Fe2+ + SO32- = FeSO3。
H++SO32—,Fe2+ + SO32- = FeSO3。
本题难度:一般
4、选择题 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3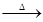 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2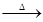 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是? (? )
A.C3N3(OH)3与HNCO为同一物质
B.1mol HNCO与NO2反应时转移3mol电子
C.HNCO是强氧化剂
D.反应中CO2是氧化产物
参考答案:B
本题解析:由C3N3(OH)3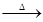 3HNCO可知,C3N3(OH)3与HNCO的化学式不同,反应属于化学变化,则C3N3(OH)3与HNCO为不同物质,所以A错误;
3HNCO可知,C3N3(OH)3与HNCO的化学式不同,反应属于化学变化,则C3N3(OH)3与HNCO为不同物质,所以A错误;
B、8HNCO+6NO2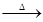 7N2+8CO+4H2O,HNCO中N元素由-3升高到0,1mol HNCO与NO2反应时转移3mol电子,B正确。
7N2+8CO+4H2O,HNCO中N元素由-3升高到0,1mol HNCO与NO2反应时转移3mol电子,B正确。
C、HNCO在反应中N元素的化合价升高,则HNCO是还原剂,错误
D、NO2在反应中N元素由+4降低到0,则NO2是氧化剂,错误;
点评:本题以信息来考查氧化还原反应,明确元素的化合价变化是解答本题的关键,分析HNCO中N为-3价、C为+4价是解答本题的难点。
本题难度:一般
5、选择题 检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2=I2+2H2O,下列对该反应的叙述中不正确的是( )。
A.I2为氧化产物
B.H2O2既作氧化剂又作还原剂
C.氧化性强弱顺序为H2O2>I2
D.生成1 mol I2时转移2 mol电子
参考答案:B
本题解析: 该反应中I2为氧化产物,H2O2作氧化剂,根据氧化性由强到弱的顺序为氧化剂>氧化产物,所以氧化性H2O2>I2;反应中每生成1 mol I2,转移2 mol电子。
该反应中I2为氧化产物,H2O2作氧化剂,根据氧化性由强到弱的顺序为氧化剂>氧化产物,所以氧化性H2O2>I2;反应中每生成1 mol I2,转移2 mol电子。
本题难度:一般