|
高中化学知识点归纳《氧化还原反应中的规律》考点预测(2017年强化版)(二)
2017-09-25 17:16:22
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 小强在奥运五连环中填入了5种物质,使相连环物质间能发生反应,不相连环物质间不能发生反应.你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数为( )
A.化合反应、3个
B.分解反应、2个
C.复分解反应、1个
D.置换反应、2个
| 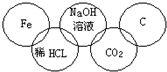
参考答案:由信息可知,相连环物质间能发生反应,不相连环物质间不能发生反应,
Fe+2HCl═FeCl2+H2↑为置换反应,HCl+NaOH═NaCl+H2O为复分解反应,
CO2+2NaOH═Na2CO3+H2O为复分解反应,CO2+C?高温?.?2CO为化合反应,
显然没有没有涉及的基本反应类型为分解反应,置换反应和有单质参加的化合反应都属于氧化还原反应,氧化还原反应为2个,
故选B.
本题解析:
本题难度:简单
2、选择题 下列关于氧化还原反应的叙述正确的是( )
A.氧化还原反应中,非金属元素的原子一定得电子被还原
B.由H2O2→O2的过程一定需加入氧化剂才能实现
C.置换反应一定是氧化还原反应,反应物中的单质作还原剂
D.标准状况下,6.72LNO2气体与足量水反应,转移的电子为0.2mol
参考答案:A.氧化还原反应中,非金属元素可以失去电子,也可以失去电子,如氯气与NaOH溶液的反应,故A错误;
B.由H2O2→O2的过程中,可以通过自身的分解反应实现,也可加氧化剂实现,故B错误;
B.置换反应中一定有元素的化合价变化,非金属单质之间的置换反应中单质作氧化剂,如氯气与KI的反应,故C错误;
D.标准状况下,6.72LNO2气体与足量水反应,NO2的物质的量为0.3mo,其中0.2mol作还原剂,N元素的化合价由+4价升高为+5价,转移的电子数为0.2mol×(5-4)=0.2mol,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
A.KClO3在反应中失去电子
B.H2C2O4在反应中是还原剂
C.ClO2是氧化产物
D.1?mol?KClO3参加反应有2?mol电子转移
参考答案:A.该反应中,氯酸钾中氯元素得电子化合价降低,所以氯酸钾是氧化剂,故A错误;
B.H2C2O4在反应中失电子化合价升高,所以H2C2O4是还原剂,故B正确;
C.氯酸钾是氧化剂,所以ClO2是还原产物,故C错误;
D.2molKClO3参加反应有2?mol电子转移,所以1molKClO3参加反应有1?mol电子转移,故D错误;
故选B.
本题解析:
本题难度:简单
4、选择题 下列反应中,不属于氧化还原反应的是( )
①3Cl2+6KOH═5KCl+KClO3+3H2O
②2NO2+2NaOH═NaNO3+NaNO2+H2O
③SnCl4+2H2O═SnO2+4HCl
④3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl.
A.①②
B.①③
C.③④
D.②④
参考答案:①3Cl2+6KOH═5KCl+KClO3+3H2O中,Cl元素的化合价既升高又降低,属于氧化还原反应;
②2NO2+2NaOH═NaNO3+NaNO2+H2O中,N元素的化合价既升高又降低,属于氧化还原反应;
③SnCl4+2H2O═SnO2+4HCl中,各元素的化合价不变,不属于氧化还原反应;
④3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl中,各元素的化合价不变,不属于氧化还原反应;
故选C.
本题解析:
本题难度:简单
5、选择题 下列关于氧化还原反应的说法正确的是( )
A.一定有氧气参加
B.一定有电子转移
C.一定属于置换反应
D.氧化反应先于还原反应
参考答案:A.是有化合价升降的反应都是氧化还原反应,不一定有氧气参加,故A错误;
B.氧化还原反应一定有电子转移,同时伴随着化合价升降,故B正确;
C.凡是有化合价升降的反应都是氧化还原反应,氧化还原反应不一定有单质反应或生成,故C错误;
D.氧化反应和还原反应是同时发生的,故D错误.
故选B.
本题解析:
本题难度:简单
| 