微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列反应中,氧化剂与还原剂的质量之比为1:1的是( )
A.2FeCl2+Cl2═2FeCl3
B.3Cl2+6NaOH═5NaCl+NaClO+3H2O
C.Cl2+2NaOH═NaCl+NaClO+H2O
D.3NO2+H2O═2HNO3+NO
参考答案:A.2FeCl2+Cl2═2FeCl3中,铁元素的化合价升高,氯元素的化合价降低,所以氯化亚铁是还原剂,氯气是氧化剂,氧化剂和还原剂的物质的量之比是1:2,故A错误;
B.3Cl2+6NaOH═5NaCl+NaClO+3H2O中,氯元素的化合价有升高的,有降低的,所以氯气既是氧化剂又是还原剂,升高的和降低的氯原子个数之比是1:5,所以氧化剂和还原剂的物质的量之比是5:1,故B错误;
C.Cl2+2NaOH═NaCl+NaClO+H2O中,氯元素的化合价有升高的,有降低的,所以氯气既是氧化剂又是还原剂,降低的和升高的氯原子个数之比是1:1,所以氧化剂和还原剂的物质的量之比是1:1,故C正确;
D.3NO2+H2O═2HNO3+NO中,氮元素的化合价有升高的有降低的,所以二氧化氮既是氧化剂又是还原剂,
降低的和升高的氮原子个数之比是1:2,所以氧化剂和还原剂的物质的量之比是1:2,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 下列有关氧化还原反应叙述正确的是
[? ]
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.非金属单质在反应中只可作氧化剂
D.金属原子失电子越多,其还原性越强
参考答案:B
本题解析:
解析;A.氧化还原反应的本质是电子的转移,而不是化合价变化,故A错误;
B.凡是有元素化合价变化的反应都属于氧化还原反应,而有单质参与的分解反应,一定有化合价的变化,故B正确;
C.所含元素化合价升高的物质作还原剂,所含元素化合价降低的物质作氧化剂,有些非金属单质化合价可升高也可降低,故C错误;
D.还原性表示的是失去电子的能力,越容易失去电子则还原性就越强,与失电子的数目无关,故D错;
所以答案选B
本题难度:简单
3、简答题 实验室可用如下反应制取氯气,反应原理如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用单线桥表示出上述反应中电子转移的方向和数目
(2)上述反应中氧化剂与还原剂的物质的量比______
(3)15.8g?KMnO4能使多少克HCl被氧化?
(4)产生的Cl2在标准状况下的体积为多少?
参考答案:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表,反应中电子转移的方向和数目为:
,
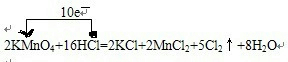
故答案为:
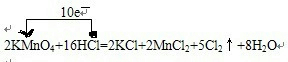
;
(2)反应中,化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,16mol的盐酸中只有10mol做还原剂,化合价降低元素是锰元素,所以高锰酸钾是氧化剂,氧化剂与还原剂的物质的量比?1:5,故答案为:1:5;
(3)设15.8g?KMnO4能氧化盐酸的质量是x,则根据方程式2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,可得高锰酸钾和被氧化的盐酸的量之间的关系为:2KMnO4~10HCl,所以
2KMnO4~10HCl
2×158? 365?
15.8g? x
则2×15815.8=365x
解得x=18.25g
答:15.8g?KMnO4能使18.25克HCl被氧化.
(4)设15.8g即0.1molKMnO4氧化盐酸产生的Cl2的物质的量是n,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,
2?5
0.1mol? n
20.1mol=5n
解得n=0.25mol,体积为:0.25mol×22.4L/mol=5.6L.
答:产生的Cl2在标准状况下的体积为5.6L.
本题解析:
本题难度:一般
4、选择题 下列反应H2O中只作氧化剂的是( )
A.2Na+2H2O=2NaOH+H2↑
B.2F2+2H2O=4HF+O2
C.Na2O+H2O=2NaOH
D.2H2O
2H2↑+O2↑
参考答案:A.该反应中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水作氧化剂、钠作还原剂,故A正确;
B.该反应中,F元素化合价由0价变为-1价,水中O元素化合价由-2价变为0价,所以氟气是氧化剂、水是还原剂,故B错误;
C.该反应中没有元素化合价变化,属于非氧化还原反应,故C错误;
D.该反应中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂,故D错误;
故选A.
本题解析:
本题难度:一般
5、选择题 2004年某一期的《美国化学杂志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80MPa下合成金刚石,具有深远意义.下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化
B.在该反应中金属钠体现了强还原性
C.在该反应中二氧化碳体现了强氧化性
D.金刚石中只含有非极性共价键
参考答案:A、二氧化碳为碳源、金属钠为还原剂,在470℃,80MPa下合成出金刚石的过程是有新物质生成的变化过程,属于化学变化,故A正确;
B、钠将很稳定的二氧化碳还原,体现了金属钠强还原性,故B正确;
C、二氧化碳为碳源、金属钠为还原剂,在470℃,80MPa下合成出金刚石的过程,碳元素化合价升降低,二氧化碳体现了氧化性,反应条件要求很高,二氧化碳的氧化性不强,故C错误;
D、同种元素之间形成的共价键为非极性键,金刚石中只含有碳碳键,是非极性键,故D正确.
故选C.
本题解析:
本题难度:一般