|
高中化学必备知识点《物质的分离、提纯》考点特训(2017年冲刺版)(四)
2017-09-25 17:16:42
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏伽德罗常数的值.下列叙述正确的是
A.1mol甲醇中含有C-H键的数目为4NA
B.12g?金刚石含有的共价键数为4NA
C.标准状况下,2.24L已烷含有分子的非极性键数目为0.5NA
D.82.5g苯丙氨酸所含有的双键数为0.5NA
参考答案:D
本题解析:分析:A、依据甲醇分子结构计算化学键数;
B、12g 金刚石物质的量为1mol,每个共价键由两个碳原子形成,每个碳原子形成四个共价键,所以含有共价键2mol;
C、标准状况己烷不是气体;
D、依据n=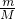 计算物质的量,结合苯丙氨酸分子结构计算双键数,苯环中无碳碳双键; 计算物质的量,结合苯丙氨酸分子结构计算双键数,苯环中无碳碳双键;
解答:A、1mol甲醇中含有C-H键的数目为3NA ,故A错误;
B、12g 金刚石物质的量为1mol,每个共价键由两个碳原子形成,每个碳原子形成四个共价键,所以含有共价键2mol,故B错误;
C、标准状况下,己烷不是气体.2.24L已烷物质的量不是0.1mol,故C错误;
D、82.5g苯丙氨酸物质的量= =0.5mol,所含有的双键为碳氧双键,双键数为0.5NA,故D正确; =0.5mol,所含有的双键为碳氧双键,双键数为0.5NA,故D正确;
故选D.
点评:本题考查阿伏伽德罗常数的分析应用,主要是物质结构分析计算微粒数,气体摩尔体积的条件应用,题目难度中等.
本题难度:困难
2、实验题 (10分)现欲分离乙酸乙酯、乙酸、乙醇的混合物,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称:

(1)写出各有关物质的名称:
A._________________,
B._________________
C._________________,
D._________________,E._________________。
| (2)写出加入的试剂:
a._____________,b._____________。
(3)写出有关的操作方法:
①_____________,②_____________,③_____________。
参考答案:(1)乙酸乙酯?乙酸钠、乙醇?乙酸钠?乙酸、硫酸钠?乙醇
(2)饱和碳酸钠?稀硫酸
(3)分液?蒸馏?蒸馏
本题解析:分离乙酸乙酯、乙酸、乙醇的混合物,可将该混合物溶解在Na2CO3(aq)中,振荡,乙酸与Na2CO3发生反应,生成醋酸钠等,这样,液体分为两层,上层为乙酸乙酯,下层为Na2CO3、醋酸钠、乙醇的混合液,分液。将下层混合液蒸馏,可得乙醇,则C为碳酸钠、醋酸钠的混合溶液。向C中加入硫酸,使溶液呈酸性,则得硫酸钠和醋酸钠的混合溶液。蒸馏可得乙酸。
本题难度:简单
3、选择题 下列各组物质中,仅用水及物质间相互反应不能区别的一组是?(?)
A.Na2O2 Al2(SO4)3 MgCl2 K2CO3
B.BaCl2 Na2SO4 Al2(SO4) 3 KOH
C.AgNO3 NaCl KCl CuCl2
D.Fe 2(SO4)3 K2CO3 KHSO4 BaCl2
参考答案:C
本题解析:
正确答案:C
A、加水有气泡的是Na2O2,生成的NaOH分别加入余下的三溶液,过量后白色沉淀消失的是Al2(SO4)3,不消失的是MgCl2;
B、某试剂加到余下的三溶液中,过量后白色沉淀消失的是Al2(SO4)3,Al2(SO4)3加入余下的二溶液中,有沉淀的是BaCl2?;
C、NaCl 、KCl无法区别;
D、黄色的是Fe 2(SO4)3,分别加入余下的三溶液,有沉淀的是BaCl2,余下的二溶液相互滴加,如果向某溶液中滴少量无气泡,过量后产生气泡,则滴入的这种试剂是K2CO3。
本题难度:简单
4、选择题 下列有关实验现象的描述或实验操作的叙述正确的是(?)
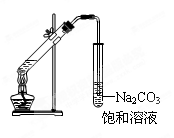

A.实验室常用右图所示的装置制取少量的乙酸乙酯

B.用热的纯碱溶液洗涤试管内壁附着的油脂

C.棉花在酒精灯的火焰上灼烧后会产生烧焦羽毛味

D.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
参考答案:B
本题解析:A不正确,试管中导管口不能插入到溶液中,以防止倒吸。纯碱水解显碱性,能溶解油脂,B正确。C不正确,应该是蛋白质。D不正确,苯的密度小于水的,有机层在上层,所以答案选B。
本题难度:一般
5、填空题 (14分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
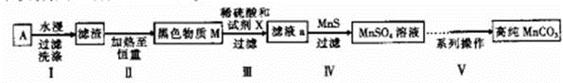
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)?
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO3的实验,得到数据如右表:

①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: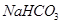 、乙醇) 、乙醇)
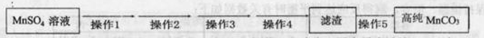
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式?
参考答案:(14分,每空2分)
(1)Zn
(2)除去碳粉
(3)Zn2++MnS=ZnS+Mn2+
(4)①30%的过氧化氢?②H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)加入NaHCO3,控制pH<7.7;?用少量无水乙醇洗涤2~3次
(6)Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
本题解析:(1) 碱性锌锰干电池中,锌比锰活泼,所以负极材料是Zn;
(2)第I步操作水浸后,溶于水的NH4CI、ZnCI2可除去,而碳粉不溶于水,所以第Ⅱ步操作的目的是除去碳粉;
(3)第Ⅳ步操作中加入MnS目的是利用沉淀的转化除去Zn2+,使MnS转化为更难溶的ZnS,离子方程式为Zn2++MnS=ZnS+Mn2+
(4)①根据表中数据选择30%的过氧化氢得到的MnSO4的质量最多,所以选择30%的过氧化氢;
②根据表可知,过氧化氢是把二氧化锰转化为硫酸锰,本身被氧化为氧气,化学方程式为H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑
(5)最终产物是碳酸锰,所以第一步应加入NaHCO3,调节pH值使之小于7.7,防止氢氧化锰生成;MnCO3潮湿时易被空气氧化,所以水洗完后再用用少量无水乙醇洗涤2~3次以除去碳酸锰表面的水分;
(6)操作1目的是生成碳酸锰的沉淀,所以可能发生反应的离子方程式Mn2++2 HCO3-= MnCO3↓+H2O+CO2↑
本题难度:困难
|