|
高考化学知识点整理《磷及其化合物》高频试题强化练习(2017年最新版)(四)
2017-09-25 17:17:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Fe跟适量的稀硝酸反应,消耗Fe和硝酸的物质的量比为1:3,产生标况下NO 6.72L,?参加反应的硝酸的物质的量为?(?)
A 1.8 mol? B 1.2 mol?C.0.6 mol? D.无法确定
参考答案:B
本题解析:生成NO0.3mol,共得电子0.9mol,假设最终铁为+2价,铁的物质的量为0.45mol,硝酸为1.35mol;假设最终铁为+3价,铁的物质的量为0.3mol,硝酸为0.9mol;故介于0.9~1.35之间
本题难度:一般
2、选择题 下列说法正确的是(?)
A.雷雨天气时空气中能生成少量的氮氧化物
B.实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气
C.铵盐化学性质都很稳定
D.O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存
参考答案:A
本题解析:略
本题难度:简单
3、实验题 某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是?(填序号,下同)。
A.将氯化铵固体加热分解
B.将浓氨水滴入氢氧化钠固体中
C.将氢氧化钠固体加入浓氨水中
D.将氯化铵稀溶液滴入氢氧化钠固体中
| (2)如图是甲同学设计收集氨气的几种装置,其中可行的是?,集气的原理是?。
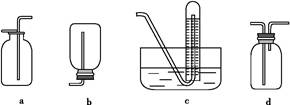
参考答案:(1)B
(2)d?利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
本题解析:(1)加热氯化铵产生氯化氢和氨气,遇冷又转化为氯化铵固体,不能制取氨气;用浓氨水与氢氧化钠固体混合制氨气时,将氨水滴入氢氧化钠固体中更方便操作,而且节约氨水的用量;氨气极易溶于水,若用稀溶液制取,产量较少。(2)氨气极易溶于水,采用向下排空气法收集。
本题难度:一般
4、选择题 在常温常压下,a, b,c,d 四支相同的试管中,分别装入以等物质的量混合的两种气体。a试管内是NO2和O2,b试管内是C12和SO2,c试管内是NO和O2,d试管内是O2和H2。将四支试管迅速同时倒立于水中,最终水面上升高度h的比较,正确的是
A.hb>hc>ha>hd
B.hc>ha>hb>hd
C.hd>ha>hc>hb
D.hb>ha>hc>hd
参考答案:A
本题解析:设气体的物质的量都是4mol,则a试管内发生的反应是4NO2+O2+2H2O=4HNO3,所以剩余气体是3mol。b试管内反应是Cl2+SO2+H2O=2HCl+H2SO4,剩余气体是0。C试管内反应是4NO+3O2+2H2O=4HNO3,所以剩余气体是1mol。D试管内气体不反应,剩余气体8mol,所以答案选A。
本题难度:简单
5、填空题 (14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为?。
 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。 ?(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)? 2NH3(g);△H=-92.2kJ/mol。
有关键能:N="N945.6kJ/mol" N-H391.0kJ/mol,则H—H键能为?。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为?。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
物质
| △H(kJ/mol)
| H2(g)
| -285.8
| CO(g)
| -283.0
| CH4(g)
| -890.3
|
?已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式?。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式?。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
?,溶液中离子浓度从大到小的顺序是?。
参考答案:
(1)
(2)436.1kJ/mol
(3)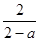
(4)CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)N2+8H++6e-=2NH+4
(6)硫酸铵和硫酸氢铵;c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题解析:(1)氨气催化氧化的化学方程式为:4NH3+5O2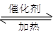 4NO+6H2O 4NO+6H2O
(2)945.6+3(H-H)-6×391.0=-92.2? H-H的键能=436.1kJ/mol
(3)N2+ 3H2 2NH3 2NH3
起始? n? 3n? 0
转化 na? 3na? 2na
平衡n(1-a) 3n(1-a)? 2na
起始的物质的量为4n,平衡时的物质的量为n(1-a)+ 3n(1-a)+2na=4n-2na
则容器内气体的压强反应前与平衡时的比值为2/(2-a)
(4)CH4和水蒸气在高温下反应得到CO和H2的热化学方程式:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(5)正极反应是:N2+8H++6e-=2NH4+
(6)所得溶液中的溶质是硫酸铵和硫酸氢铵,溶液中离子浓度从大到小的顺序是:c(NH+4)>c(SO2-4)>c(H+)>c(OH-)
本题难度:一般
| 