微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将5.6克不纯的铁与足量稀硫酸反应,生成氢气0.2克。该不纯的铁含有的杂质可能是
A.碳和锌
B.铁锈
C.碳和铝
D.碳
参考答案:C
本题解析:略
本题难度:一般
2、选择题 300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol/L Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度约为?
A.0.4 mol/L
B.0.3 mol/L
C.0.2 mol/L
D.0.1 mol/L
参考答案:D
本题解析:300mlAl2(SO4)3含有1.62gAl3+,可以得出含有Al3+:1.62g/27mol=0.06mol
所以含有0.09molSO42-(根据化学式对应摩尔比例可以得出)
滴入300ml的0.1mol/L的Ba(OH)2后会发生反应(滴入n=cV=0.3L?0.1mol/L="0.03mol" )
3Ba(OH)2+Al2(SO4)3=2Al(OH)3↓+3BaSO4↓如果加多了会生成偏铝酸钡 ,反应中Ba2+与SO42-的沉淀比是1:1,所以每沉淀1molBa2+就有1molSO42-也跟着沉淀 ,所以沉淀0.03molBa2+,也就沉淀0.03molSO42-,所以剩余0.06molSO42- ,
接下来算混合溶液的体积 ,总共600ml=0.6L
所以c="n/V=0.06mol/0.6L=0.1mol/L"
所以SO42-的物质量浓度为0.1mol/L
点评:了解其中发生的反应,运用物质的量的概念进行计算。
本题难度:一般
3、选择题 下列叙述正确的是?(?)
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1 mol Cl2与足量的铁反应,转移的电子数为3NA
C.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
D.1.00molNaCl中,所有Na+的最外层电子总数为10×6.02×1023
参考答案:C
本题解析:A错,氯化钠为离子化合物,没有氯化钠分子;B错,1 mol Cl2与足量的铁反应,转移的电子数为2NA;C正确;D错,1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023;
本题难度:一般
4、选择题 设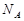 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A.23g钠与足量氧气充分反应,转移的电子个数为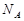
B.将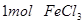 水解制成胶体,所得胶体的微粒数为
水解制成胶体,所得胶体的微粒数为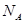
C.1mol Na2O2与水完全反应时转移电子数为2NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
参考答案:A
本题解析:钠在反应中只能失去1个电子,A正确。水解反应是可逆的,所以氯化铁不可能完全都生成氢氧化铁胶体,B不正确。过氧化钠和水中,过氧化钠既是氧化剂,也是还原剂,所以应该转移1个电子,C不正确。NA个一氧化碳分子的质量是28g,0.5mol甲烷是8g,所以二者的质量之比是7∶2,D不正确,答案选A。
本题难度:简单
5、选择题 只给出下列甲和乙中对应的量,不能求出物质的量的是( )
?
| A
| B
| C
| D
|
甲
| 物质的粒子数
| 标准状况下的气体摩尔体积
| 固体的体积
| 溶液中溶质的物质的量浓度
|
乙
| 阿伏加德罗常数
| 标准状况下的气体体积
| 固体的密度
| 溶液的体积
|
?
参考答案:C
本题解析:根据n=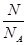 、n=
、n=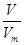 、n=cV可知,A、B、D中都能求出物质的量。
、n=cV可知,A、B、D中都能求出物质的量。
本题难度:一般