微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将9.2g金属钠投入到足量水中,得ag溶液;9.6g镁投入到足量盐酸中(与水等质量),得到bg溶液,则反应后两溶液质量的关系是 (?)
A.a>b
B.a=b
C.a<b
D.无法判断
参考答案:B
本题解析:将9.2g金属钠与水反应后生成H2的质量为0.4g;9.6g镁投入到足量盐酸中生成H2的质量为0.8g;设足量盐酸(与水等质量)的质量为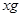 ,则
,则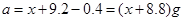 ;
;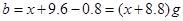 ,因此可得
,因此可得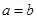 。故答案为B。
。故答案为B。
点评:本题是对物质反应的计算,属于基础题。解题时,对于计算溶液的质量时,应考虑加入的物质(形成溶液),以及“跑出去”的物质(气体),对于形成溶液的,应加;对于生成气体的,应减。
本题难度:一般
2、选择题 在100 mL 0.10 mol/L的AgNO3溶液中加入100 mL溶有2.08 g BaCl2的溶液,再加入100 mL溶有0.01 mol CuSO4·5H2O的溶液,充分反应,则下列说法中正确的是(? )
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的量为0.02 mol
D.最终得到的溶液相当于一种纯净物的溶液
参考答案:B
本题解析:由题可知AgNO3的物质的量为0.01mol,BaCl2的物质的量为0.01mol,CuSO4·5H2O的物质的量为0.01 mol,充分反应后,得到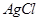 和
和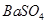 的白色沉淀,其物质的量分别都是0.01mol,溶液中含有的离子有
的白色沉淀,其物质的量分别都是0.01mol,溶液中含有的离子有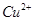 、
、 、
、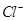
A.最终得溶液中含有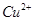 ,溶液显蓝色,A项错误;
,溶液显蓝色,A项错误;
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物,正确;
C.在最终得到的溶液中,Cl-的物质的量应该为0.01mol,C项错误;
D.最终得到的溶液相当于混合物的溶液,D项错误。
点评:本题考查离子反应,对溶液中物质的定量计算,本题解答的关键在先求出反应的各物质的物质的量,再根据方程式即可求得所要结果。
本题难度:一般
3、选择题 如果1g水中含有n个氢原子,则阿伏加德罗常数是?(?)
A.n/1mol-1?B.9n mol-1?C.2nmol-1?D.nmol-1
参考答案:B
本题解析:略
本题难度:简单
4、选择题 Mol是那个物理量的单位( )
A.质量
B.长度
C.摩尔质量
D.物质的量
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知硫酸的质量分数越大时,其溶液的密度越大;已知98%的浓硫酸的浓度为18.4mol/L,则49%的硫酸溶液的浓度为
A.9.2mol/L
B.>9.2mol/L
C.<9. 2 mol/L
D.无法确定