微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于在一密闭容器中进行的反应:C(s)+O2(g)===CO2(g),下列说法中错误的是
[? ]
A.将木炭粉碎成粉末状可以加快化学反应速率
B.升高温度可以加快化学反应速率
C.增加压强可以加快化学反应速率
D.增加木炭的量可以加快化学反应速率
参考答案:D
本题解析:
本题难度:一般
2、选择题 2SO2+O2?2SO3是工业上制造硫酸重要反应之一.下列关于该反应的说法正确的是( )
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.若反应在密闭容器中进行,2molSO2和1molO2能够生成2molSO3
参考答案:A.增加O2的浓度,单位体积活化分子数目增多,反应速率增大,故A正确;
B.温度降低,反应速率减小,故B错误;
C.使用催化剂,可增大反应速率,故C错误;
D.该反应为可逆反应,反应物不可能完全转化,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 有H+浓度相同、体积相等的三种酸:a、盐酸b、硫酸c、醋酸,同时加入足量的锌,则开始时反应速率由大到小的顺序是______(用a、b、c表示),完全反应后生成H2的体积由大到小是______.
参考答案:H+浓度大小影响生成氢气的反应速率,H+浓度相同,则开始时的反应速率相同,即a=b=c;
醋酸为弱酸,不能完全电离,则H+浓度相同时酸的浓度最大,盐酸和硫酸都为强酸,H+浓度相同、溶液体积相同,则H+物质的量相同,则完全反应后生成H2的体积由大到小是c>a=b,
故答案为:a=b=c;c>a=b.
本题解析:
本题难度:一般
4、选择题 过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
[? ]
A.升高温度
B.加入适量的水
C.加入少量CuSO4
D.加入浓度较大的盐酸
参考答案:B
本题解析:
本题难度:一般
5、实验题 (7分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
实验室利用反应2H2O2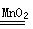 2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
2H2O+O2↑可制备氧气。① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号
| 条件
| 现象
| 结论
|
温度/℃
| 催化剂
|
1
| 40
| FeCl3溶液
|
|
|
2
| 20
| FeCl3溶液
|
|
|
3
| 20
| MnO2
|
|
|
4
| 20
| 无
|
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是
实验中可以表明该反应速率差异的现象是
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 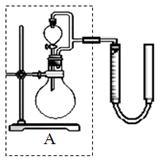
参考答案:(7分).①温度(1分) 比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异 产生气泡的快慢 ② 旋转分液漏斗的活塞,控制滴加H2O2溶液的速率 (除注明外每空2分)
本题解析:①根据表中数据可知,实验1和2中不同的是温度,所以实验1、2研究的是温度对H2O2分解速率的影响;实验2、3中不同的是催化剂,所以其实验的目的是比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异。
②避免反应过于剧烈方法是控制加入双氧水的速率,所以正确的操作是旋转分液漏斗的活塞,控制滴加H2O2溶液的速率。
考点:考查外界条件对反应速率的影响
点评:在判断或验证外界条件对反应速率的影响时,需要注意的是,不能同时改变2个或多个条件,否则无法验证或判断。应该是在其它条件不变的情况下,逐步改变进行验证。同时还需要设计对比实验,以保证实验的科学性和准确性。
本题难度:一般