微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在铁片与稀硫酸的反应中,加入如下试剂或操作,可使生成氢气速率加快但生成氢气的量不变的是( ?)
A.硫酸钠晶体
B.不用稀硫酸,改用98%浓硫酸
C.不用铁片,改用铁粉
D.加热
参考答案:CD
本题解析:考查外界条件对反应速率的影响。其它条件不变的情况下,参加反应的物质的浓度越大、或升高温度,或增大反应物的接触面积等均可以加快反应速率,所以选项CD正确,A不正确。浓硫酸使铁发生钝化,因此选项B不正确,答案选CD。
本题难度:一般
2、选择题 今有等质量且足量的两份锌粉a和b,分别加入适量的等体积、等浓度的稀硫酸,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
[? ]
A.
B.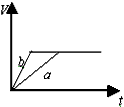
C.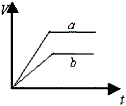
D.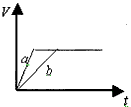
参考答案:D
本题解析:
本题难度:一般
3、实验题 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为
1.00 mol·L-1、2.00mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验
HNO3的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号
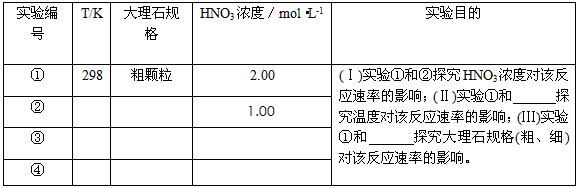
(2)实验①中CO2质量随时间变化的关系见下图
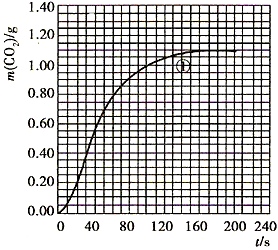
依据反应方程式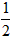 CaCO3+HNO3==
CaCO3+HNO3== Ca(NO3)2+
Ca(NO3)2+ CO2↑+
CO2↑+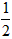 H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
参考答案:(1) (2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
(2)70至90s内,CO2生成的质量为:m(CO2)=0.95g-0.84g=0.11g,
其物质的量为n(CO2)=0.11g÷44g·mol-1=0.0025mol,
根据方程式比例,可知消耗HNO3的物质的量为:n(HNO3)=0.0025mol×2=0.005mol,
溶液体积为25mL=0.025L,所以HNO3减少的浓度△c(HNO3)=0.2mol·L-1,
所以HNO3在70-90S范围内的平均反应速率为v(HNO3)=0.01mol·L-1·s-1。
本题解析:
本题难度:困难
4、填空题 某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min)
| 1
| 2
| 3
| 4
| 5
|
氢气体积(mL)
| 50
| 120
| 232
| 290
| 310
|
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
参考答案:(11分)(1)2~3 min(1分),因该反应是放热反应,此时温度高(2分);4~5 min (2分),因为此时H+ 浓度小(2分)(时间段错误,不得分)
(2)υ(HCl)=0.1 mol/(L·min)(2分,无单位或单位错误扣1分)
(3)A、B (各1分,共2分,多选1个扣1分)
本题解析:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、120ml-50ml=70mL、232ml-120ml=112mL、290ml-232ml=68mL、310ml-290ml=20mL,由此可知反应速率最大的时间段为2~3 min。这是由于该反应为放热反应,温度升高,温度对反应速率的影响超过浓度对反应速率的影响,所以反应速率增大。反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,即浓度对反应速率的影响超过温度对反应速率的影响,因此反应速率降低。
(2)在2~3min时间段内,n(H2)=0.112L÷22.4L/mol==0.005mol,根据2HCl~H2可知,消耗盐酸的物质的量为0.01mol,其浓度为0.01mol÷0.1L=0.1mol/L,则υ(HCl)=0.1mol/L÷1min=0.1 mol/(L?min)。
(3)A、加入蒸馏水,H+浓度减小,反应速率减小,且不减少产生氢气的量,故A正确;B、加入Na2SO4溶液,相当于稀释,H+浓度减小,反应速率减小且不减少产生氢气的量,故B正确;C、加入NaNO3溶液,在酸性条件下NO3-具有强氧化性,与金属反应得不到氢气,而是生成NO气体,影响生成氢气的量,故C错误;D、加入CuSO4溶液,Zn置换出Cu反应速度增大。但由于消耗锌,从而影响生成氢气的量,故D错误;E、加入Na2CO3溶液,消耗H+,H+浓度减小,影响生成氢气的量,故E错误,所以答案选AB。
考点:考查外界条件对反应速率的影响、影响反应速率条件的实验探究以及反应速率的计算
本题难度:一般
5、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是(?)。
A.增大反应物的量
B.升高温度
C.增大压强
D.使用催化剂
参考答案:B
本题解析:在影响反应速率的因素,只要升高温度,反应速率就一定是加快的,而压强、浓度、催化剂则是不一定加快反应速率,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,旨在答题的灵活性。侧重对学生的能力的培养,该题的关键是明确浓度和压强对反应速率影响的适用范围,然后结合题意灵活运用即可。
本题难度:简单