微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (20分)近年来大气问题受到人们越来越多的关注。按要求回答下列问题:
Ⅰ.实现反应CH4(g)+CO2(g) 2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。
2CO(g)+2H2(g),△H0,对减少温室气体排放和减缓燃料危机具有重要意义。在2L密闭容器中,通入5mol CH4与5mol CO2的混合气体,一定条件下发生上述反应,测得CH4的平衡转化率与温度、压强的关系如图。

则p1、p2、p3、p4由大到小的顺序 ,该反应的正反应是______(填“吸热”或“放热”)反应,当1000℃甲烷的转化率为80%时,该反应的平衡常数K=________。
Ⅱ.PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2=-1160kJ·mol-1
CH4(g)+2NO2 (g)= N2(g) + CO2(g)+2H2O(g) △H3
则△H3= ,如果三个反应的平衡常数依次为K1、K2、K3,则K3=__________(用K1、K2表示)
(2)实验室可用NaOH溶液吸收SO2,某小组同学在室温下,用pH传感器测定向20mL0.1mol·L-1NaOH溶液通入SO2过程中的pH变化曲线如图所示。

①ab段发生反应的离子方程式为________________。
②已知d点时溶液中溶质为NaHSO3,此时溶液中离子浓度由大到小的顺序为_______,如果NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则该温度下H2SO3的第一步电离平衡常数Ka=________________。
参考答案:Ⅰ.p4>p3>p2>p1;吸热,1024mol2·L-2;
Ⅱ.(1)-867kJ·mol-1;K3=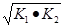
(2)①SO2+2OH-=SO32-+H2O
②c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
10-2mol·L-1
本题解析:I.由图可知,温度降低,转化率下降,则可知该反应为吸热反应,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
2CO(g)+2H2(g)为体积增大的反应,压强增大,平衡逆移,故有p4>p3>p2>p1;
CH4(g)+CO2(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
始 5mol 5mol 0 0
转 4mol 4mol 8mol 8mol
平 1mol 1mol 8mol 8mol
平衡浓度:0.5mol/L 0.5mol/L 4mol/L 4mol/L
所以:K= =1024mol2/L2
=1024mol2/L2
II.(1)CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ·mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3
那么△H3= =-867kJ/mol
=-867kJ/mol
因△H3= ,那么K3=
,那么K3=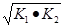
(2)向20mL0.1mol·L-1NaOH溶液通入SO2,由过程中的pH变化曲线可知。a-b段发生的反应是二氧化硫和氢氧化钠反应生成亚硫酸钠,,离子方程式为SO2+2OH-=SO32-+H2O;d点时溶液中溶质为NaHSO3,溶液显酸性,离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);当NaHSO3的水解平衡常数Kh=1×10-12mol·L-1,则Ka= =10-2mol/L。
=10-2mol/L。
考点:反应热的计算,平衡常数的计算,离子方程式的书写,离子浓度大小的比较
本题难度:困难
2、选择题 已知:H2(g) + Br2(g) → 2HBr(g) ΔH= —72 kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,其它相关数据如下表:则上述表格中的a值为
一定状态的分子
| H2(g)
| Br2(l)
| HBr(g)
|
1 mol该分子中的化学键断裂吸收的能量/kJ
| 436
| a
| 369
|
A.404 B.344 C.260 D.200
参考答案:C
本题解析:H2(g) + Br2(g) → 2HBr(g) ΔH=" —72" kJ/mol,1mol Br2(g)液化放出的能量为30 kJ,则H2(g) + Br2(g) → 2HBr(g) ΔH=" —42" kJ/mol,由于反应热就是断裂化学键吸收的热量与形成化学键释放的热量的差,所以Br-Br的键能是436+a-369×2="—42" kJ,解得a=+260KJ/mol,故选项是C。
考点:考查反应热与物质存在的状态、化学键的键能的关系的知识。
本题难度:一般
3、简答题 工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺线路如下:

Ⅰ、碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
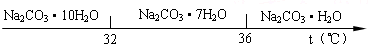
Ⅱ、25℃时有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe?(OH)3
Ksp
4.96×10-9
6.82×10-6
4.68×10-6
5.61×10-12
2.64×10-39
|
回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为______.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=______.
(2)“趁热过滤”时的温度应控制在______.
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线所示进行循环使用.请你分析实际工业生产中是否可行______,并说明理由______.
(4)已知:Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ?mol-1Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H=+473.63kJ?mol-1写出Na2CO3?H2O脱水反应的热化学方程式______.
参考答案:(1)碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、CaCO3沉淀,滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3,发生的发应有:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg (OH) 2↓+CO32-;根据氢氧化镁和氢氧化铁的溶解平衡以及溶度积表达式,则当两种沉淀共存且溶液的pH=8时,c(Mg2+)=Ksp[OH-]2=5.61×10-1210-12=5.61mol/L,c(Fe3+)=Ksp[OH-]3=2.64×10-3910-18=2.64×10-21mol/L,
所以?c(Mg2+):c(Fe3+)=5.61:2:.64×10-21=2.215×1021,
故答案为:Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2↓+CO32-;?2.215×1021;
(2)“趁热过滤”的原因是使析出的晶体为Na2CO3?H2O,防止因温度过低而析出Na2CO3?10H20晶体或Na2CO3?7H20晶体,所以温度高于36℃,故答案为:高于36℃;
(3)若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质,这样不符合该提纯工艺,故答案为:不可行;若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质;
(4)通过观察两个热化学方程式,利用盖斯定律,可将两式相减得到Na2CO3?H2O(S)═Na2CO3(s)+H2O(g),
即Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol,
故答案为:Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol.
本题解析:
本题难度:一般
4、选择题 含有NaOH 20.0 g的稀溶液与足量的稀盐酸反应,放出28.7 kJ的热量。能正确表示该反应中和热的热化学方程式是 ( )
A.NaOH +HCI
B.NaOH( aq)+HC1( aq)
C.NaOH(1)+HCl(1)
D.NaOH( aq)+HCl( aq)