微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验事实不能用平衡移动原理解释的是( )
A.

?
将NO2球浸泡在冷水和热水中
B.
| t/℃ | 25 | 50 | 100
KW/10-14
1.01
5.47
55.0
|
C.
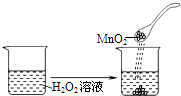
D.| C(氨水)/(mol?L-1) | 0.1 | 0.01
pH
11.1
10.6
|
参考答案:A.存在平衡2NO2?N2O4,且正反应是放热反应,升高温度,平衡向逆反应方向移动,所以气体颜色加深,可以用平衡移动原理来解释,故A不选;
B.水是弱电解质,存在电离平衡H2O?H++OH-,电离过程是吸热过程,升高温度,促进水的电离,氢离子与氢氧根离子的浓度增大,水的离子积中增大,可以用平衡移动原理解释,故B不选;
C.过氧化氢分解,加入的二氧化锰起催化剂的作用,加快过氧化氢分解,不能用平衡移动原理解释,故C选;
D.氨水中存在平衡NH3?H2O?NH4++OH-,浓度越稀,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,故D不选;
故选C.
本题解析:
本题难度:简单
2、选择题 某恒温恒容的容器中,建立如下平衡:2NO2(g) N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时
N2O4(g),在相同条件下,若分别向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内N2O4的体积分数比原平衡时
[? ]
A.都增大
B.都减小
C.前者增大后者减小
D.前者减小后者增大
参考答案:A
本题解析:
本题难度:一般
3、简答题 在真空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)?PH3(g)+HI(g)
4PH3(g)?P4(g)+6H2(g)
2HI(g)?H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为d mol.
(1)平衡后,容器内P4(g)和PH3的物质的量(用代数式表示):n(P4)=______;n(PH3)=______.
(2)a、b、c三者服从a>______(填b、c的代数式);b、c、d三者的关系服从b>______(填c、d的代数式).
(3)平衡后,增大压强,容器内n(I2)______,n(PH4I)______(填增大、减小、不变).
参考答案:建立平衡后,测得HI为bmol、I2(g)为cmol、H2为dmol,根据化学反应,则
PH4I(s)?PH3(g)+HI(g)
b+2cb+2cb+2c
4PH3(g)?P4(g)+6H2(g)
2(d-c)3 d-c6d-c
2HI(g)?H2(g)+I2(g)
2c c c
(1)平衡后,容器内P4(g)的物质的量是d-c6mol,PH3的物质的量是(b+2c)mol-2(d-c)3mol=(8c3+b-2d3)mol,
故答案为:d-c6;(8c3+b-2d3);
(2)在真空密闭容器内加入amol PH4I固体,由于反应是可逆的,所以a>b+2c;8c3+b-2d3>0,即b>2d3-8c3,
故答案为:a>b+2c;b>2d3-8c3;
(3)平衡后,增大压强,平衡PH4I(s)?PH3(g)+HI(g)逆向移动,平衡4PH3(g)?P4(g)+6H2(g)逆向移动,平衡2HI(g)?H2(g)+I2(g)不移动,所以结果是容器内n(I2)减小,n(PH4I)增大,
故答案为:减小;增大.
本题解析:
本题难度:简单
4、选择题 在密闭容器中,反应X2(g)+2Y2(g)?2XY2(g)△H<0达到甲平衡,若只改变某一条件再达到乙平衡,则对此过程条件改变的分析正确的是( )
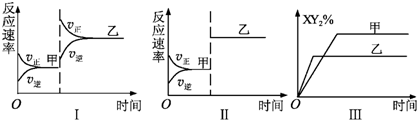
A.图Ⅰ由甲至乙加入适当催化剂
B.图Ⅱ由甲至乙扩大容器体积
C.图Ⅲ由甲至乙增大压强
D.图Ⅲ由甲至乙升高温度
参考答案:反应X2(g)+2Y2(g)?2XY(g)△H<0,正反应为体积减小的放热的反应,
A.加入催化剂,正、逆反应速率同等程度增大,平衡不移动,图象与实际不相符,故A错误;
B.扩大体积,压强减小,正逆反应速率都降低,平衡向逆反应,逆反应速率降低较少,图象中平衡不移动,图象与实际不相符,故B错误;
C.增大压强,反应速率加快,到达平衡时间缩短,平衡向正反应方向移动,平衡时XY2的含量增大,但图象中乙到达平衡时XY2的含量较小,与实际不符,故C错误;
D.升高温度,应速率加快,到达平衡时间缩短,平衡向逆反应方向移动,平衡时XY2的含量减小,图象与实际相符,故D正确,
故选D.
本题解析:
本题难度:简单
5、选择题 下列图示与对应的叙述相符的是?
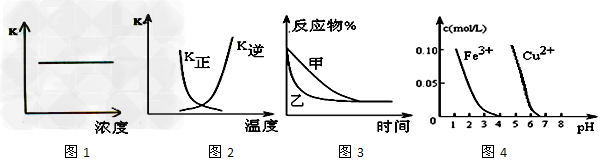
[? ]
A.图1表示反应2NO(g)+2CO(g)?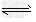 ?N2(g)+2CO2(g)平衡常数K?随NO物质的量的变化
?N2(g)+2CO2(g)平衡常数K?随NO物质的量的变化
B.图2中表示反应2A(g)?+?B(g)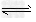 ?2C(g)?ΔH?>?0的平衡常数K随温度的变化
?2C(g)?ΔH?>?0的平衡常数K随温度的变化
C.图3表示压强对可逆反应2A(g)+2B(g)?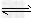 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5左右
参考答案:A
本题解析:
本题难度:一般