微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关化学用语使用正确的是
A.乙酸、葡萄糖、淀粉的最简式均为CH2O
B.醛基的电子式: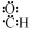
C.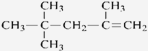 的名称为:2,4,4-三甲基-1-戊烯
的名称为:2,4,4-三甲基-1-戊烯
D.乙醇分子比例模型: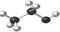
参考答案:C
本题解析:略
本题难度:简单
2、简答题 将6.4g铜与100g98%H2SO4在烧瓶中加热发生反应.
(1)铜完全溶解后,计算生成的气体在标准状况下的体积是多少?
(2)将反应后烧瓶中的物质配成500mL溶液.
①在配制过程中用到的仪器有______;配制溶液时,若稀释后立即转移并定容,则所配得的溶液浓度______(填“偏大”“偏小”或“不变”).
②求所配得溶液中H2SO4的物质的量浓度.
参考答案:(1)6.4gCu的物质的量为6.4g64g/mol=0.1mol,则:
Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O
1? 1
0.1mol? n(SO2)
所以n(SO2)=0.1mol,故V(SO2)=0.1mol×22.4L/mol=2.24L
答:标准状况下SO2的体积是2.24L;
(2)配成500mL溶液所用仪器为:500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管.
配制溶液时,若稀释后立即转移并定容,没有恢复室温,溶液的温度偏高,恢复室温后溶液的体积偏小,结合c=nV可知,所配溶液的浓度偏大,
故答案为:500mL容量瓶、烧杯、量筒、玻璃棒、胶头滴管,偏大;
②原硫酸溶液中H2SO4的质量为100g×98%=98g,故原酸溶液中H2SO4的物质的量为98g98g/mol=1mol,
?Cu+2H2SO4(浓)?△?.?CuSO4+SO2↑+2H2O
? 1?2?
0.1mol? 0.2mol
计算所配溶液中n(H2SO4)=1mol-0.2mol=0.8mol,所配得溶液中H2SO4的物质的量浓度为0.8mol0.5L=1.6mol/L,
答:所配得溶液中H2SO4的物质的量浓度为1.6mol/L.
本题解析:
本题难度:一般
3、选择题 下列表达式错误的是(?)
A.甲基的电子式: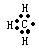
B.碳原子的价电子轨道表示式: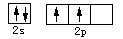
C.硫离子的核外电子排布式:1s22s22p6
D.碳-14原子:14 6C
参考答案:C
本题解析:根据构造原理可知,硫离子的核外电子排布式是1s22s22p63s23p6,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型。试题基础性强,注重能力的培养和训练,有利于培养学生的应试能力,提高学生的学习效率。常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住并能灵活运用。
本题难度:一般
4、填空题 (12分) 在反应SO2 + Cl2 + 2H2O =" 2HCl" + H2SO4中,氧化剂是:______,
还原剂是:_______________,被氧化的物质是:________,发生还原反应的物质是:___________. 当
当 有1mol的HCl生成时,反应中转移的电子数是:__________mol,参加反应的SO2的质量_________克.
有1mol的HCl生成时,反应中转移的电子数是:__________mol,参加反应的SO2的质量_________克.
参考答案:(12分)氧化剂是:__ Cl2?____,还原剂是:_____SO2________,
被氧化的物质是:___ SO2____,发生还原反应的物质是:___ Cl2_____.
Cl2_____.
反应中转移的电子数是:____1_____mol, SO2的质量____32_____克.
本题解析:略
本题难度:简单
5、填空题 (6分)试从元素化合价的角度分析Fe3+、Fe2+、H+、S2?、Zn、SO2、S、Cl?等粒子在氧化还原反应中可能表现出的性质:只有氧化性的是_____________;只有还原性的是____________;既有氧化性又有还原性的是_______________。
参考答案:

本题解析:略
本题难度:简单