微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知反应AsO43- +2I- +2H+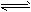 AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2 均为石墨电极),分别进行下述操作:
AsO33-+I2+H2O是可逆反应。设计如图装置(C1、C2 均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液结果发现电流计指针均发生偏转。
据此,下列判断正确的是
[? ]
A.操作I过程中,C1为正极
B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液
C.操作I过程中,C2棒上发生的反应为:AsO43-+2H+ +2e-=AsO33-+H2O
D.操作Ⅱ过程中,C1棒上发生的反应为:2I- =I2 +2e-
参考答案:C
本题解析:
本题难度:一般
2、简答题 如图是利用质量相等的Cu片和Ag片及500mL?AgNO3溶液组成的原电池,一段时间后,正、负两极质量差为14g,若溶液体积不变,计算:
(1)电路中转移电子的物质的量为______.
(2)溶液中AgNO3的物质的量浓度变化了______.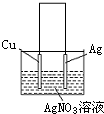
参考答案:Cu片和Ag片及500mL?AgNO3溶液组成的原电池中,正极:Ag++e-→Ag,负极:Cu-2e-→Cu2+,设电路中转移电子的物质的量为n,则正极质量增加108n,负极质量减少32n,所以108n+32n=14g,解得n=0.1mol,故答案为:0.1mol;
(2)当电路中转移0.1mol电子时,根据正极反应:Ag++e-→Ag,则减少的银离子物质的量为0.1mol,C=nV=0.1mol0.5L=0.2mol/L,所以溶液中AgNO3的物质的量浓度减少0.2mol/L,故答案为:0.2mol/L(减少).
本题解析:
本题难度:一般
3、选择题 野外作业时,可用原电池反应放出的热量来加热食品.由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑( )
A.作正极,发生还原反应
B.作负极,发生氧化反应
C.作阴极,发生还原反应
D.作阳极,发生还原反应
参考答案:由铁屑、炭粒、食盐、水、空气组成的原电池中,铁屑做负极,炭粒作正极,在负极上是电极本身发生失电子的氧化反应.
故选B.
本题解析:
本题难度:简单
4、选择题 下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1?mol电子转移,则生成1?molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
参考答案:A.电解池阴极上得电子发生还原反应,故A错误;
B.用惰性电极电解Na2SO4溶液,阴极上析出氢气,阳极上析出氧气,氢离子得2mol电子生成1mol氢气,4mol氢氧根离子失去4mol电子生成1mol氧气,所以阴阳两极产物的物质的量之比为2:1,故B错误;
C.设生成x氢氧化钠,
2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑转移电子
? 2mol?2mol
?x? ? 1mol
x=2mol×1mol2mol=1mol,
所以生成1mol氢氧化钠,故C正确;
D.镀层破损后,镀锡铁板中铁作负极,镀锌铁板中铁作正极,所以镀锌铁板比镀锡铁板更耐腐蚀,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是
[? ]
①在标准状况下,每消耗5.6L?CH4可以向外电路提供2mole- ②通过甲烷电极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O ③通过甲烷的电极为电池的正极,通过氧气的电极为负极 ④电池放电后,溶液pH不断升高
A.①②?
B.①③?
C.①④?
D.③④
参考答案:A
本题解析:
本题难度:一般