微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 mgCu与足量浓硫酸完全反应,得到nLSO2(标准状况),被还原的硫酸是
[? ]
A.64n/22.4mol
B.98n/22.4g
C.m/64mol
D.64n/22.4g
参考答案:BC
本题解析:
本题难度:一般
2、选择题 铜和镁的合金2.14g完全溶于一定浓度的硝酸,若反应中硝酸被还原为NO2、NO、N2O三种气体而且在标准状况下它们的体积均为0.224L.在反应后的溶液中,加入足量的氢氧化钠溶液,生成的沉淀经过滤、洗涤、干燥后称量,质量为( )
A.4.18g
B.3.12g
C.4.68g
D.5.08
参考答案:A
本题解析:
本题难度:简单
3、填空题 过度排放CO2会造成温室效应,最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把
CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下
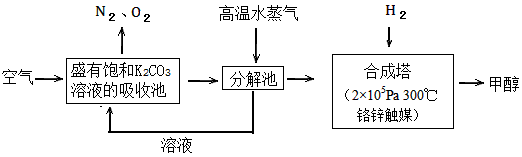
(1)写出吸收池中主要反应的离子方程式_________________;在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式
________________。
(2)“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括________。
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式________________。当电子转移的物质的量为________时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)工业上常以CO和H2为主要原料,生产甲醇。某密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
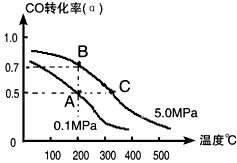
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数
K=__________;此时在B点时容器的体积VB________10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA________tC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是______________(答出两点即可)。
参考答案:(1)CO32-+ CO2+H2O==2HCO3-;CO2(g)+3H2(g) ==CH3OH(g)+H2O(g) ΔH=-49.47kJ/mol
(2)高温水蒸气
(3)CH3OH+8OH--6e-==CO32-+6H2O;1.2mol
(4)①1(L/mol)2;小于;②大于;③降温、加压、将甲醇从混合体系中分离出来(任意两点即可)
本题解析:
本题难度:一般
4、选择题 在强酸性溶液中可发生如下反应:2Mn2++5R2O
+8H2O16H++10RO+2MnO,这个反应可定性地检验Mn2+的存在.在反应中充当氧化剂的R2O中x的值是( )
A.0
B.1
C.2
D.3
参考答案:由离子反应可知,反应后离子电荷总数为16×(+1)+10×(-2)+2×(-1)=-6,
则反应前离子的电荷总数为2×(+2)+5×(-x)=-6,解得x=2,
故选C.
本题解析:
本题难度:一般
5、计算题 实验室用17.4g MnO2与足量的浓度为12mol/L的浓盐酸反应制取氯气。
(1)产生的Cl2在标准状况下的体积为多少?
(2)理论上被氧化的HCl的物质的量为多少?
(3)为什么实际操作中所需的浓盐酸比理论中要多?
(4)若将反应后的溶液配制成500mL溶液,则该溶液中MnCl2的物质的量浓度是多少?
参考答案:(1)4.48L
(2)0.4mol
(3)因为HCl会挥发,而且二氧化锰与稀盐酸不反应
(4)0.4mol/L
本题解析:
本题难度:简单