微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)MnO2是重要无机材料,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3,其中Fe2O3质量百分含量为10%)样品转化为纯MnO2实验,其流程如下:
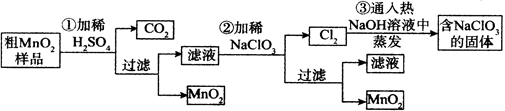
(已知:氧化性强弱顺序: ClO3-> MnO2 > Fe3+)
(1)铝与二氧化锰在高温下发生铝热反应,相关反应的化学方程式为: 。
(2)第②步反应离子方程式为: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、 、 ;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有 (写化学式)。
(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: 。
(5)若粗MnO2样品的质量为28.2g,第①步反应后,经过滤得到17.4g MnO2,并收集到448mL CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3才能将Mn2+完全转化为MnO2。
参考答案:(1)2Al+ 3MnO2 3Mn + 2Al2O3(3分)
3Mn + 2Al2O3(3分)
(2)5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+(3分)
(3)酒精灯 蒸发皿(2分,各1分)NaCl(2分)
(4)MnO2 + e- + H2O =" MnO(OH)" + OH-或2MnO2 + 2e- + H2O = Mn2O3 + OH-(3分)
(5)0.04(3分)
本题解析:(1)铝与二氧化锰在高温下发生铝热反应,产生氧化铝和锰,反应的化学方程式为:2Al+ 3MnO2 3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
考点:考查化学反应方程式和离子方程式的书写、混合物分离方法的操作方法及仪器的使用、原电池电极反应式的书写、关于化学反应方程式的计算的知识。
本题难度:一般
2、选择题 实验室中欲快速制取氢气,最好的方法应该用
[? ]
A.纯锌与稀H2SO4
B.纯锌与浓H2SO4
C.粗锌与稀HNO3
D.粗锌与稀H2SO4
参考答案:D
本题解析:
本题难度:一般
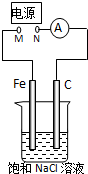
3、选择题 如图所示,将纯Fe棒和石墨棒插入1L?饱和NaCl溶液中.下列说法正确的是( )
A.去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡
B.M连接电源正极,N连接电源负极,则Fe棒被保护不会溶解
C.M连接电源负极,N连接电源正极,当两极产生气体总量为 22.4mL(标准状况)时,则生成0.001mol NaOH
D.M连接电源负极,N连接电源正极,如果把烧杯中的溶液换成1L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀